Hỗn hợp khí A gồm clo và oxi, A phản ứng vừa hết với một hỗn hợp gồm 4,8g Mg và 8,1g Al tạo ra 37,05g hỗn hợp các muối clorua và oxit của 2 kim loại. Xác định thành phần % theo khối lượng của hỗn hợp khí A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hỗn hợp khí A gồm clo và oxi, A phản ứng vừa hết với một hỗn hợp gồm 4,8g Mg và 8,1g Al tạo ra 37,05g hỗn hợp các muối clorua và oxit của 2 kim loại. Xác
Link tham khảo của bài cj Linh

Đáp án A

Gọi số mol các chất trong A là Cl2 : a mol ; O2 : b mol
Sơ đồ phản ứng:

Tổ hợp (1) và (2) ta được : a = 0,25 mol ; b = 0,2 mol
Phần trăm khối lượng Cl2 trong A là:
![]()

n Mg = 3,6/24 = 0,15(mol)
n Al = 5,4/27 = 0,2(mol)
Gọi n Cl2 = a(mol) ; n O2 = b(mol)
Bảo toàn e :
2n Cl2 + 4n O2 = 2n Mg + 3n Al
<=> 2a + 4b = 0,15.2 + 0,2.3 = 0,9(1)
Bảo toàn khối lượng :
m X + m Al + m Mg = m Z
=> 71a + 32b = 29,95 - 3,6 -5,4 = 20,95(2)
Từ (1)(2) suy ra a = 0,25 ; b = 0,1
%m O2 = 0,1.32/(0,25.71 + 0,1.32) .100% = 15,27%

Gọi số mol Cl 2 và O 2 lần lượt là x và y, ta có hệ phương trình:
2x+4y = 0,4+0,9 ( ĐL bảo toàn e) x=0,25
71x+32y = 24,5 ( ĐL bảo toàn khối lượng) y=0,2

$n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)$
$n_{Al} = \dfrac{8,1}{27} = 0,3(mol)$
Gọi $n_{Cl_2} = a(mol) ; n_{O_2} = b(mol)$
Ta có :
Bảo toàn khối lượng $\to 4,8 + 8,1 + 71a + 32b = 37,05$
Bảo toàn electron $0,2.2 + 0,3.3 = 2a + 4b$
Suy ra : a = 0,25 ; b = 0,2
$\%V_{Cl_2} = \dfrac{0,25}{0,25 + 0,2}.100\% = 55,56\%$

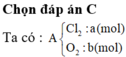
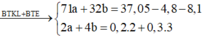
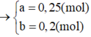
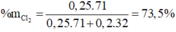
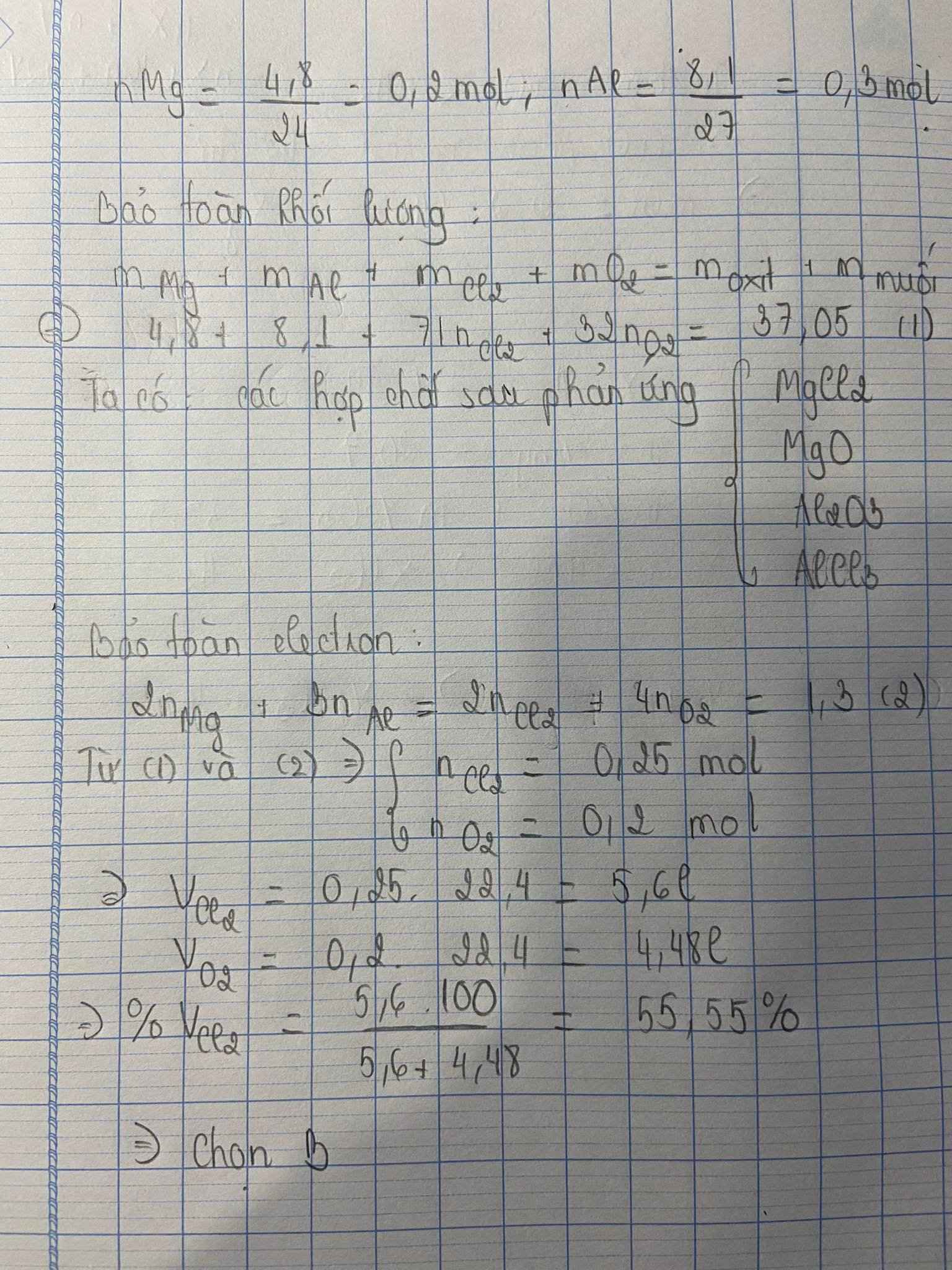
\(Mg^o+Mg^{+2}\rightarrow2e\)
0,2____________0,4
\(Al^o+Al^{+3}\rightarrow3e\)
0,3_________0,9
\(Cl_2+2e\rightarrow2Cl^-\)
x_____2x_______
\(O_2+4e\rightarrow2O^{2-}\)
y____4y______
\(\rightarrow2x+4y=1,3\left(1\right)\)
\(m_{hh_{spu}}=m_{Mg}++m_{Al}+m_{Cl2}+m_{O2}\)
\(\rightarrow m_{Cl2}+m_{O2}=m_{hh}-m_{Mg}-m_{Al}\)
\(=37,05-4,8-8,1\)
\(\rightarrow71x+32y=24,15\left(2\right)\)
Giải hai hệ phương trình (1) và (2) :
\(\left\{{}\begin{matrix}x=0,25\\y=0,2\end{matrix}\right.\)
\(\rightarrow n_{Cl2}=0,25\rightarrow m_{Cl2}=0,25.72=17,75\left(g\right)\)
\(\rightarrow\%_{Cl_2}=\frac{17,75}{24,15}.100\%=73,5\%\)