Dẫn 4.48 lít khí SO2(đktc) vào 300ml dung dịch KOH 1M thu được dung dịch A. Tính CM của dung dịch A? (biết thể tích dung dịch sau phản ứng không thay đổi)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


250ml = 0,25l
\(n_{H2SO4}=1,5.0,25=0,375\left(mol\right)\)
\(n_{Na2SO3}=\dfrac{37,8}{126}=0,3\left(mol\right)\)
a) Pt : \(H_2SO_4+Na_2SO_3\rightarrow Na_2SO_4+SO_2+H_2O|\)
1 1 1 1 1
0,375 0,3 0,3 0,3
b) Lập tỉ số so sánh : \(\dfrac{0,375}{1}>\dfrac{0,3}{1}\)
⇒ H2SO4 dư , Na2SO3 phản ứng hết
⇒ Tính toán dựa vào số mol của Na2SO3
\(n_{SO2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) \(n_{Na2SO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(n_{H2SO4\left(dư\right)}=0,375-0,3=0,075\left(mol\right)\)
\(C_{M_{Na2SO4}}=\dfrac{0,3}{0,25}=1,2\left(M\right)\)
\(C_{M_{H2SO4\left(dư\right)}}=\dfrac{0,075}{0,25}=0,3\left(M\right)\)
Chúc bạn học tốt

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
_____0,2---->0,2------>0,2----->0,2
VH2 = 0,2.22,4 = 4,48(l)
\(C_{M\left(ZnSO_4\right)}=\dfrac{0,2}{0,3}=0,667M\)

nCO2=0,075 mol
CO2 + 2KOH => K2CO3 + H2O
0,075 mol =>0,075 mol
CM dd K2CO3=0,075/0,25=0,3M

$2KOH + CO_2 \to K_2CO_3 + H_2O$
$n_{K_2CO_3} = n_{CO_2} = \dfrac{1,68}{22,4} = 0,075(mol)$
$V_{dd} = V_{dd\ KOH} = 0,25(lít)$
$C_{M_{K_2CO_3}} = \dfrac{0,075}{0,25} = 0,3M$
nCO2=0,075(mol)
PTHH: CO2 + 2 KOH -> K2CO3 + H2O
Vddmuoi= VddKOH=0,25(l)
=> nK2CO3=nCO2=0,075(mol)
=>CMddK2CO3=0,075/0,25=0,3(M)

Chọn B
n C O 2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
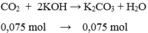
Vì thể tích dung dịch trước và sau không thay đổi


a)
$n_{KOH} = \dfrac{44,8}{56} = 0,8(mol)$
$n_{SO_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
Ta thấy : $n_{KOH} : n_{SO_2} = 0,8 : 0,3 = 2,67 > 2$ nên dung dịch sau phản ứng có : $KOH$ dư ; $K_2SO_3$
b)
$n_{K_2SO_3} = n_{SO_2} = 0,3(mol)$
$\Rightarrow m_{K_2SO_3} = 0,3.158 = 47,4(gam)$
$n_{KOH\ dư} = 0,8 - 0,3.2 = 0,2(mol)$
$\Rightarrow m_{KOH\ dư} = 0,2.56 = 11,2(gam)$

a, Ta có: \(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(n_{KOH}=\dfrac{44,8}{56}=0,8\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{SO_2}}=1,3333\)
⇒ Dd sau pư gồm: K2SO3 và KHSO3.
b, PT: \(SO_2+2KOH\rightarrow K_2SO_3+H_2O\)
\(SO_2+KOH\rightarrow KHSO_3\)
Giả sử: \(\left\{{}\begin{matrix}n_{K_2SO_3}=x\left(mol\right)\\n_{KHSO_3}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}x+y=0,6\\2x+y=0,8\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{K_2SO_3}=0,2.158=31,6\left(g\right)\\m_{KHSO_3}=0,4.120=48\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
n SO2 = 4,48/ 22,4 = 0,2 mol
n KOH = 0,3*1 = 0,3 mol
n SO2 < n KOH --> n KOH dư
SO2 + 2KOH --- K2SO3 + H2O
0,2 < 0,3 0,2
CM K2SO4 = 0,2/0,3 = 0,666 M
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{KOH}=0,3.1=0,3\left(mol\right)\)
Ta có: \(T=\dfrac{n_{KOH}}{n_{SO_2}}=\dfrac{0,3}{0,2}=1,5\) ⇒ tạo ra muối K2SO3 và KHSO3
PTHH: SO2 + 2KOH → K2SO3 + H2O
Mol: x 2x x
PTHH: SO2 + KOH → KHSO3
Mol: y 2y y
Ta có: \(\left\{{}\begin{matrix}x+y=0,2\\2x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(C_{M_{ddK_2SO_3}}=\dfrac{0,1}{0,3}=0,333M\)
\(C_{M_{ddKHSO_3}}=\dfrac{0,1}{0,3}=0,333M\)