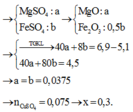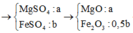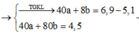Cho 1,36 gam hỗn hợp Fe và Mg vào 400ml CuSO4 a M. Sau khi các phản ứng xảy ra hoàn toàn, được chất rắn A nặng 1,84 gam và dung dịch B. Cho hết B tác dụng với dung dịch NaOH dư, rồi lấy kết tủa nung ngoài không khí đến khối lượng không đổi, được hỗn hợp D nặng 0,2 gam. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu và giá trị a (M)?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mg + CuSO4 ---> MgSO4 + Cu (1)
Fe + CuSO4 ----> FeSO4 + Cu (2)
MgSO4 + 2NaOH ----> Mg(OH)2 + Na2SO4 (3)
FeSO4 + 2NaOH ----> Fe(OH)2 + Na2SO4 (4)
Mg(OH)2 ---> MgO + H2O (5)
4Fe(OH)2 + O2 ----> 2Fe2O3 + 4H2O (6)
( Ghi điều kiện hộ mk)
Theo đề bài mFe + mMg = 1,36 (g)
Theo phương trình (1,2,3,4,5,6) thì mFe2O3 + mMgO = 1,2 < 1,36 ( Vô lí)
Vậy CuSO4 thiếu , kim loại dư=>chỉ xảy ra PT 1,3,5
Gỉa sử chỉ có Mg phản ứng , gọi số mol của Mg phản ứng là x mol
Mg + CuSO4 ---> MgSO4 + Cu
\(x=\frac{1,84-1,36}{64-24}=0,012\left(mol\right)\)
Theo PT 1,3,5
\(nMg=nMgO=0,012\left(mol\right)\Rightarrow mMgO=0,012\cdot40=0,48\left(mol\right)< 1,2\left(Vôlí\right)\)
Vậy Mg phản ứng hết và Fe phản ứng 1 phần
Gọi số mol Mg là x , số mol Fe ban đầu là y , Fe phản ứng là z
theo PT 1,2,3,4,5,6 ta có:
+) 24x + 56y = 1,36
+) 64x + 64z + 56y - 56z = 1,84
+) 40x + 80z = 1,2
Giải hệ phương trình ta đc
\(\left\{{}\begin{matrix}x=0,01\\y=0,02\\z=0,01\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}mFe=0,02\cdot56=1,12\left(g\right)\\mMg=0,01\cdot24=0,24\left(g\right)\end{matrix}\right.\)
nCuSO4 phản ứng = 0,01+0,01 = 0,02(mol)
\(a=\frac{0,02}{0,4}=0,05M\)

Gọi a, b là số mol Mg, Fe phản ứng.
Mg+CuSO4→MgSO4+Cu
a_____a_______a____a
Fe+CuSO4→FeSO4+Cu
b____b_______b_____b
(Nếu giải ra b>0 thì Fe đã phản ứng. Nếu giải ra b=0 thì Fe chưa phản ứng)
MgSO4+2NaOH→Mg(OH)2+Na2SO4
a________________a
FeSO4+2NaOH→Fe(OH)2+Na2SO4
b________________b
Mg(OH)2→MgO+H2O
a_________a
4Fe(OH)2+O2→2Fe2O3+4H2O
b_____________\(\dfrac{b}{2}\)
5,1-24a-56b+64(a+b)=6,9
=> \(\left\{{}\begin{matrix}\text{5a+b=0,225
}\\40a+160\dfrac{b}{2}=4,5\end{matrix}\right.\)Giải hệ, được a=b=0,0375
%mMg=24.0,0375/5,1.100%=17,65%
%mFe=100%-17,65%=82,35%
Số mol Fe có trong A bằng\(\dfrac{\text{(5,1-24.0,0375)}}{56}\)=0,075(mol)
Fe dư và CuSO4 phản ứng hết.
nCuSO4=a+b=0,0375+0,0375=0,075(mol)
CM(CuSO4) =0,075/0,25=0,3(M)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) => 24a + 56b = 5,1 (1)
- Nếu Fe tan hết:
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: \(n_{Fe_2O_3}=0,5b\left(mol\right)\)
=> 40a + 160.0,5b = 4,5
=> 40a + 80b = 4,5 (2)
(1)(2) => Nghiệm âm (vô lí)
=> Trong X có Fe
Gọi nFe(pư) = x (mol)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
a---->a------------------->a
Fe + CuSO4 --> FeSO4 + Cu
y---->y------------------->y
=> 64(a + y) + 56(b - y) = 6,9
=> 64a + 56b + 8y = 6,9 (3)
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: nFe2O3 = 0,5y (mol)
=> 40a + 80y = 4,5 (4)
(1)(3)(4) => \(\left\{{}\begin{matrix}a=0,0375\left(mol\right)\\b=0,075\left(mol\right)\\y=0,0375\left(mol\right)\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{0,0375.24}{5,1}.100\%=17,647\%\)
b) \(n_{CuSO_4}=a+y=0,075\left(mol\right)\)
=> \(C_{M\left(CuSO_4\right)}=\dfrac{0,075}{0,25}=0,3M\)
c) X gồm \(\left\{{}\begin{matrix}Cu:0,075\left(mol\right)\\Fe:0,0375\left(mol\right)\end{matrix}\right.\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
=> \(n_{SO_2}=0,13125\left(mol\right)\)
=> \(V_{SO_2}=0,13125.22,4=2,94\left(l\right)\)

Đáp án D
M g S O 4 : : a F e S O 4 : b → M g O : a F e 2 O 3 : 0 , 5 b → → T G K L 40 a + 8 b = 6 , 9 - 5 , 1 40 a + 80 b = 4 , 5 → a = b = 0 , 0375 → n C u S O 4 = 0 , 075 → x = 0 , 3

Gọi a, b là số mol Mg, Fe phản ứng.
Mg+CuSO4→MgSO4+Cu
a_____a_______a____a
Fe+CuSO4→FeSO4+Cu
b____b_______b_____b
(Nếu giải ra b>0 thì Fe đã phản ứng. Nếu giải ra b=0 thì Fe chưa phản ứng)
MgSO4+2NaOH→Mg(OH)2+Na2SO4
a________________a
FeSO4+2NaOH→Fe(OH)2+Na2SO4
b________________b
Mg(OH)2→MgO+H2O
a_________a
4Fe(OH)2+O2→2Fe2O3+4H2O
b______________b/2
5,1-24a-56b+64(a+b)=6,9
=> 5a+b=0,225
40a+160b/2=4,5
Giải hệ, được a=b=0,0375
%mMg=24.0,0375/5,1.100%=17,65%
%mFe=100%-17,65%=82,35%
Số mol Fe có trong A bằng(5,1-24.0,0375)/56=0,075(mol)
Fe dư và CuSO4 phản ứng hết.
nCuSO4=a+b=0,0375+0,0375=0,075(mol)
CM(CuSO4) =0,075/0,25=0,3(M) → Đáp án D
Cho 5,1 gam hỗn hợp gồm Mg và Fe vào 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, lọc, thu được 6,9 gam chất rắn X và dung dịch Y chứa hai muối. Thêm dung dịch NaOH dư vào dung dịch Y. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi được 4,5 gam chất rắn Z.
a) Tính thành phần phần trăm theo khối lượng của Mg trong hỗn hợp ban đầu.
b) Tính nồng độ mol của dung dịch CuSO4.
c) Tính thể tích khí SO2 (đo ở đktc) thu được khi hoà tan hoàn toàn 6,9 gam chất rắn X trong dung dịch H2SO4 đặc, nóng.
cho mình hỏi câu này với ạ