Cho 1,03 gam muối natri halogen (NaX) tác dụng hết với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau phản ứng phân huỷ hoàn toàn cho 1,08 gam Ag. X là gì
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)

Chọn đáp án B
NaY + A g N O 3 → N a N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,01 (mol)
=> 0,01(23 + M Y ) = 1,03 => M Y = 80 (Br)

nAg = 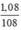 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 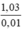 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

nAg=0,01 mol
NaX+AgN03------->NaN03+AgX,áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
0,01--------------------------------0,01
MNaX=1,03/0,01=103------------------->X=80------->Br

Chọn đáp án B
NaY + A g N O 3 → A g N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,03 (mol
0,03(23+ M Y ) = 3,09 => M Y = 80 (Br)

Đáp án : B
NaX + AgNO3 -> NaNO3 + AgX
x mol -> x mol
=> 2,06/(23 + X) = 3,76/(108 + X)
=> X = 80 (Br)

Phản ứng xảy ra như sau:
NaX + AgNO3 \(\rightarrow\) NaNO3 + AgX\(\downarrow\)
0,03 0,03 0,03 mol 4,305 g
Áp dụng định luật BTKL ta có: 0,03(23 + X) + 170.0,03 = 85.0,03 + 4,305
Giải pt thu được: X = 35,5 (Clo)
Như vậy, công thức cần tìm là: NaCl (Natri clorua).

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

Gọi muối A có công thức tổng quát dạng NaX. ( X thuộc nhóm VIIA - halogen - là nguyên tử khối, là kí hiệu tổng quát)
PTHH: NaX+AgNO3→AgX+NaNO3 (1)
1(mol) --------------> 1(mol)
AgX→Ag+X (2)
1(mol)---> 1(mol)
Theo đề, ta có: nNaX=1,0323+X(mol);nAg=1,08/108=0,01(mol)
Theo 2 phương trình:nNaX=nAgX=nAg⇔1,0323+X=0,01⇔X=80
Vậy X là Br (Brom).
Vậy muối A là NaBr: Natri Bromua.
\(NaX+AgNO_3\rightarrow NaNO_3+AgX\)
\(2AgX\rightarrow2Ag+X_2\)
\(n_{Ag}=\frac{1,08}{108}=0,1\left(mol\right)\)
\(\rightarrow n_{NaX}=n_{Ag}=0,1\left(mol\right)\)
\(M_{NaX}=\frac{1,03}{0,01}=103\left(\frac{g}{mol}\right)\)
\(\rightarrow M_X=80\)
Vậy X là Brom