Bài 1:Cho 6 gam hỗn hợp Mg và MgO tác dụng với dung dịch HCl 20% có d = 1,1g/ml.Khi phản ứng kết thúc thu được 2,24 lít khí ở đktc.
a.Tính % khối lượng của mỗi chất rắn có trong hỗn hợp trước phản ứng.
b. Tính thể tích dung dịch HCl cần dùng.
c.Tính C% của chất tan có trong dung dịch sau phản ứng
Bài 2:Cho 6,5 gam hỗn hợp Zn và ZnO tác dụng với dung dịch HCl 16% thu được V lít khí.Đốt cháy toàn bộ lượng khí này thu được 0,9 gam nước.
a.Tính : V=?
b.Tính phần trăn khối lượng mỗi chất có trong hỗn hợp ban đầu.
c.Tính C% của chất tan có trong dung dịch sau phản ứng với axit.


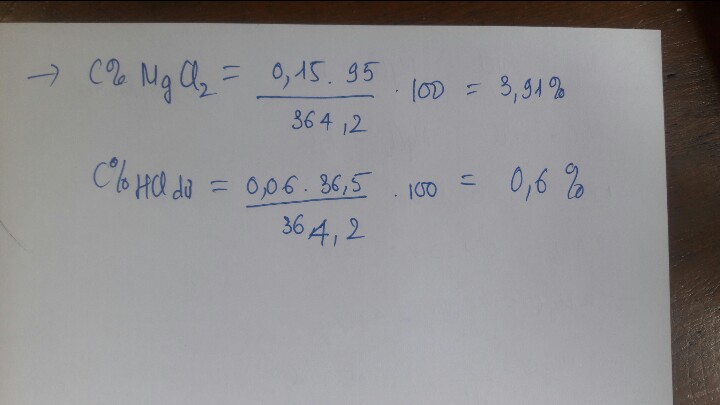
Bài 1:
a) Gọi x là số mol Mg
y là số mol MgO
Theo bài ra ta có:
24x + 40y = 6(I)
Ta có PT:
Mg + 2HCl ---> MgCl2 + H2
..x.......2x............x............x
MgO + 2HCl ---> MgCl2 + H2O
..y............2y..............y............y
n\(H_2\)= \(\frac{2,24}{22,4}\)=0,1(mol) =x
=> y=0,09
mMg= 24.0,1=2,4(g)
%mMg=\(\frac{2,4}{6}\).100% = 40%
%mMgO= 100%-40%=60%
b) nHCl = 2x + 2y = 0,38(mol)
=> mHCl = 36,5.0,38=13.78(g)
=> mdd HCl 16% = \(\frac{13,78.100}{16}\)=86,7(g)
Vdd HCl = 86,7.1,1=95,37(ml)
c) Áp dụng ĐLBTKL ta có:
mhh + mdd HCl = m dd muối + m\(H_2\)
=> m dd muối = 6 + 86,7 - 0,2 = 92,5(g)
C%\(MgCl_2\)=\(\frac{95.0,19}{92,5}\).100%=19,51%