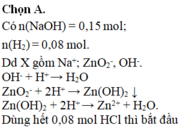Hỗn hợp A gồm: NaOH, Na2CO3 và Na2SO4. Lấy 10.54 gam A hòa tan hết vào nước cất, được dung dịch B. Thêm từ từ dung dịch HCl 0.25M vào dung dịch B cho đến khi bọt khí vừa bắt đầu xuất hiện thì ngừng, thấy dùng hết 440ml dung dịch HCl 0,25M. Mặt khác, khi cho 0,195 mol hỗn hợp A tác dụng với dung dịch BaCl2 dư, thu được 21,765g kết tủa.
a. Xác định từng chất trong 10,54 gam hỗn hợp A
b. Nếu nhỏ từ từ dung dịch B (ở trên) vào dung dịch HCl (dư) đến khi thu được 448ml ̣(đktc) khí CO2 thì ngừng. Tính số mol axit HCl đã tham gia phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
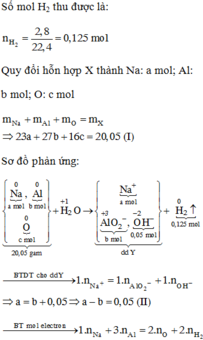
Quy đổi X về Na a mol, Al b mol và O c mol.
→ 23a + 27b + 16c = 20,05
Hòa tan hết X vào nước thu được 0,125 mol khí H2
Bảo toàn e: + 3b - 2c = 0,125. 2
Khi thêm 0,05 mol HCl vào Y mới thấy xuất hiện kết tủa chứng tỏ số mol của NaOH dư là 0,05 mol
→ a - b = 0,05 (BT Na)
Giải được: a=0,3; b=0,25; c=0,4.
Vậy dung dịch Y chứa 0,05 mol NaOH dư và 0,25 mol NaAlO2
Sau khi trung hòa hết NaOH dư nếu thêm 0,31 mol HCl nữa thì kết tủa thu được sẽ có 0,23 mol Al(OH)3.
→ m = 17,94 gam

Giải thích:
Đặt x, y, z là số mol Na, Al, O
Phương trình 1 theo khối lượng đi: 23x + 27y + 16z = 20,05
Phương trình 2 bảo toàn điện tích: x + 2y = 0,125.2 + 2z
Phương trình 3 tính theo số mol OH-: nOH- = nNa= nAl + nH+ => x + y = 0,05
Giải hệ được : x= 0,3 ; y = 0,25 ; z = 0,4
n kết tủa = (4.nAlO2- - nH+)/3 = (4.0,25 – 0,31)/3 = 0,23 mol
=> m = 17,94g
Đáp án A

Đáp án A
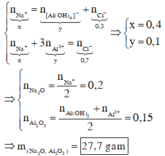
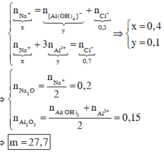
nNaOH dư =0,1
=> NaAlO2 phản ứng với 0,2 mol HCl
=> a= 0,2.78 = 15,6 (g)
Đồng thời 0,6 mol HCl thu được 0,2 mol Al(OH)3
=> 0,4 mol HCl tham gia phản ứng:
A l O 2 - + 4 H + → A l 3 + + 2 H 2 O
→ n A l O 2 - =0,2+0,1=0,3
→ n A l 2 O 3 =0,15
n N a 2 O =0,15+0,1:2=0,2
→ m = 0,2.62+0,15.102 = 27,7 g

Đáp án B
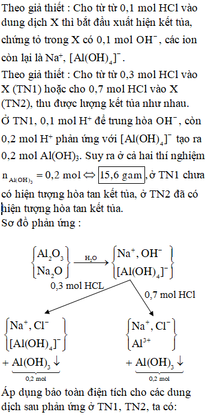
Cho từ từ 0,1 mol HCl vào dung dịch X thì bắt đầu xuất hiện kết tủa, chứng tỏ trong X có 0,1 mol OH - , các ion còn lại là Na+, Al OH 4 - .
Cho từ từ 0,3 mol HCl vào X (TN1) hoặc cho 0,7 mol HCl vào X (TN2), thu được lượng kết tủa như nhau. Ở TN1, 0,1 mol H+ để trung hòa OH - , còn 0,2 mol H+ phản ứng với Al OH 4 - tạo ra 0,2 mol Al(OH)3. Suy ra ở cả hai thí nghiệm
![]()
ở TN1 chưa có hiện tượng hòa tan kết tủa, ở TN2 đã có hiện tượng hòa tan kết tủa.
Sơ đồ phản ứng :
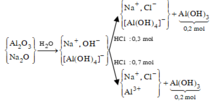
Áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng ở TN1, TN2, ta có :

Đáp án D
Có n(NaOH) = 0,15 mol; n(H2) = 0,08 mol.
Dd X gồm Na+; ZnO2-, OH‑.
OH- + H+ → H2O
ZnO2- + 2H+ → Zn(OH)2 ↓
Zn(OH)2 + 2H+ → Zn2+ + H2O.
Dùng hết 0,08 mol HCl thì bắt đầu có kết tủa → n(OH-) = 0,08 mol.
Khi cho 0,32 mol HCl hay 0,48 mol HCl vào dd X đều thu được a gam kết tủa.
Có:
n(H+ trước) = 2.n↓ + n(OH-) → n↓ = (0,32 – 0,08) : 2 = 0,12 mol.
n(H+ sau) = 4.n(ZnO2-) – 2n↓ + n(OH-) → n(ZnO2-) = 0,16 mol.
BTĐT trong dd X → n(Na+) = 0,4 mol.
BTNT (H): n(NaOH) + 2n(H2O) = 2.n(H2) + n(OH-)
→ n(H2O) = (2.0,08 + 0,08) : 2 = 0,045 mol.
BTKL: m(hh) + m(NaOH) + m(H2O) = m(H2) + m(Na+) + m(ZnO2-) + m(OH-)
→ m = (0,08.2 + 23.0,4 + 0,16.97 + 0,08.17) – (0,15.40 + 0,045.18) = 19,43 gam.