Đem hòa tan 2,7 g kim loại A trong 50 g dung dịch HCl được dung dịch X. Để trung hòa dung dịch X cần 50 g dung dịch NaOH 8%, được dung dịch Y. Trong dung dịch Y, NaCl có nồng độ 5,71%. Tìm A?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


NaOH = 0,1 mol => HCl dư 0,1 mol và NaCl = 0,1 mol
=> khối lượng dd Y = 0,1. 58,5: 5,71% = 102,452
BTKL => mH2 = 2,7+50+50 - 102,452 = 0,248g
=> Số mol H2 = 0,124 mol
=> HCl pư = 0,248 mol
=> tổng HCl = 0,348 mol
=> C% của HCl = 0,348. 36,5: 50 = 25,404%.

Rainbow đề chưa chắc đã sai đâu bn! Đề cho biết: để trung hòa X chứng tỏ trong X vẫn còn axit dư, còn lượng NaOH đề cho để trung hòa hết lượng HCl dư đó bn :) Khi cho NaOH vào thì pư trung hòa sẽ xảy ra trước và ko còn NaOH để muối ACln kịp pư đâu :)
NaOH = 0,1 mol => HCl dư 0,1 mol và NaCl = 0,1 mol
=> khối lượng dd Y = 0,1. 58,5: 5,71% = 102,452
BTKL => mH2 = 2,7+50+50 - 102,452 = 0,248g => Số mol H2 = 0,124 mol=> HCl pư = 0,248 mol => tổng HCl = 0,348 mol => C% của HCl = 0,348. 36,5: 50 = 25,404%.

Câu 3. Hòa tan 13,7 gam Ba trong 250ml H2O (D = 1,008 g/ml) thu được dung dịch X và khí Y (đktc)
a) Tính C% của dung dịch X.
b) Lấy 212,4 gam dung dịch X tác dụng với 14,7 gam dung dịch H2SO440% thu được dung dịch Z. Tìm C% các chất tan trong Z.
Giải :
\(a)n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\\ Ba+H_2O\rightarrow Ba\left(OH\right)_2+H_2\\ n_{Ba\left(OH\right)_2}=n_{H_2}=n_{Ba}=0,1\left(mol\right)\\m_{H_2}=0,1.2=0,2\left(g\right)\\ m_{H_2O}=250.1,008=252\left(g\right)\\ m_{ddsaupu}=13,7+252-0,2=265,5\left(g\right)\\ C\%_{Ba\left(OH\right)_2}=\dfrac{0,1.171}{265,5}.100=\dfrac{380}{59\%}= 6,44\%\\b)n_{Ba\left(OH\right)_2}=\dfrac{212,4.\dfrac{380}{59}\%}{171} =0,08\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{14,7.40\%}{98}=0,06\left(mol\right)\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ Lậptỉlệ:\dfrac{0,08}{1}>\dfrac{0,06}{2}\Rightarrow Ba\left(OH\right)_2dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,06\left(mol\right)\\ m_{ddsaupu}=212,4+14,7-0,06.233=213,12\left(g\right)\\ n_{Ba\left(OH\right)_2pư}=n_{H_2SO_4}=0,06\left(mol\right)\\ n_{Ba\left(OH\right)_2dư}=0,08-0,06=0,02\left(mol\right)\\ \Rightarrow C\%_{Ba\left(OH\right)_2dư}=\dfrac{0,02.171}{213,12}.100=1,61\%\)
5. \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{37,6}.100=14,89\%;\%m_{Fe_2O_3}=100-14,89=85,11\%\)

Giải thích:
nOH- = nH+ = nHCl = ( 50.3,65%):(100%. 36,5) = 0,05 (mol)
X + nH2O → X(OH)n + nH2↑
=> MX = 1,15 : 0,05n = 23n
Vậy n = 1 => MX = 23 => Na
Đáp án A

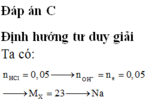
2A + 2nHCl → 2ACln + nH2↑ (1)
mNaOH = 50 . 8% = 4g
nNaOH = \(\frac{4}{40}\) = 0,1 mol
NaOH + HCl → NaCl + H2O
0,1 → 0,1 → 0,1
mNaCl = 0,1 . 58,5 = 5,85 (g)
\(m_Y=\frac{5,85}{5,71}.100\%=102,45\left(g\right)\)
Bảo toàn khối lượng:
mX + mNaOH = mY
→ mX = 102,45 - 50 = 52,45 (g)
mA + mdd HCl = mX + mH2
→ mH2 = 2,7 + 50 - 52,45 = 0,25 (g)
nH2 = 0,25 : 2 = 0,125 mol
Theo (1): nA =\(\frac{2}{n}\)nH2 = \(\frac{0,25}{n}\)mol
\(M_A=\frac{2,7}{\frac{0,25}{n}}=10,8n\)
Tự tính tiếp