Cho 1,86 gam hỗn hợp Mg và Al vào dung dịch HNO3 loãng, dư thấy có 560 ml khí N2O(đktc) duy nhất bay ra. Tính khối lượng của Mg trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận: 2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
⇒ %mMg = 0 , 01 × 24 1 , 86 × 100 = 12,9%

Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận:
2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
⇒ %mMg = 12,9%

Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận: 2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
![]()

\(n_{N_2O}=0,025\) mol
Bảo toàn Nitơ:
\(n_{NO_3^-}=8n_{N_2O}=0,2\) mol
\(m_{NO_3^-}=0,2.62=12,4\) g
\(m_{muoi}=m_{NO_3^-}+m_{hhkl}=1,86+12,4=14,26\) g
Cách 2 nha :
Gọi số mol Al là x; Mg là y
\(\rightarrow\) 27x+24y=1,86 gam(1)
Ta có: nN2O=\(\frac{0,56}{22,4}\)=0,025 mol
Bảo toàn e:
3nAl +2nMg=8nN2O
\(\rightarrow\) 3x+2y=0,025.8(2)
Từ (1) và (2)
\(\left\{{}\begin{matrix}\text{27x+24y=1,86}\\\text{3x+2y=0,025.8}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}\text{x=0,06}\\\text{y=0,01 }\end{matrix}\right.\)
Muối tạo ra là Al(NO3)3 0,06 mol và Mg(NO3)2 0,01 mol
\(\rightarrow\)m muối=14,26 gam

560ml= 0,56l
gọi x ,y lần lượt là số mol của Mg và Al
pthh : 4Mg + 10HNO3 ---> 4 Mg(NO2)2 + N2O +5H2O(1)
x 1/4x
Al +6HNO3 ---> Al(NO3)3 + 3N2O + 3H2O(2)
y 3y
24x +27y= 1,86
ta có hệ phương trình :
1/4x + 3y = 0,56/ 22,4
giải hệ phương trình ta được x= 0,075 ,y=0,002
theo pthh (1) n Mg(NO3)2 = n Mg = 0,075 mol
_______(2) n Al(NO3)3 = n Al = 0,002 mol
---> m muối = m Mg(NO3)2 + m Al(NO3)3
= 0,075. 148 + 0,002 .213
=11,526(g)

Đáp án B
Do dung dịch Y tăng 21,28 gam.
→ m X = 28 , 96 - 21 , 28 = 7 , 68 g a m T a c ó : n X = 7 , 68 9 , 6 . 4 = 0 , 2 m o l
Do vậy ta giải được số mol CO2 và NO trong X lần lượt là 0,06 mol và 0,08 mol.
Vậy số mol FeCO3 là 0,06 mol.
Do khi thêm AgNO3 vào Y có xuất hiện NO nên H+ dư nên Y không có NO3- dư.
Bảo toàn N: n N H 4 + = 0 , 24 - 0 , 06 . 2 - 0 , 08 = 0 , 04 m o l
Gọi a, b lần lượt là số mol Mg, Fe3O4, c là số mol HCl.
Do vậy kết tủa chứa AgCl c mol và Ag.
→ 24 a + 232 b + 0 , 06 . 116 = 28 , 96
Do cho AgNO3 vào sinh ra 0,03 mol NO nên H+ dư 0,12 mol.
Bảo toàn e kết hợp bảo toàn điện tích:
c= 0,04+8b+0,06.2+0,08.3+0,06.8+0,04.8+0,12
Bảo toàn e:
n A g = 2 a + b + 0 , 06 - 0 , 04 . 8 - 0 , 08 . 3 - 0 , 03 . 3 - 0 , 06 . 8 = 2 a + b - 1 , 07 → 143 , 5 c + 108 ( 2 a + b - 1 , 07 ) = 238 . 58
Giải được: a=0,53; b=0,04; c=1,64.
%Mg= 43,92%

Đáp án B
Do dung dịch Y tăng 21,28 gam.
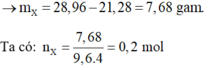
Do vậy ta giải được số mol CO2 và NO trong X lần lượt là 0,06 mol và 0,08 mol.
Vậy số mol FeCO3 là 0,06 mol.
Do khi thêm AgNO3 vào Y có xuất hiện NO nên H+ dư nên Y không có NO3- dư.
Bảo toàn N:
![]()
Gọi a,b lần lượt là số mol Mg, Fe3O4, c là số mol HCl.
Do vậy kết tủa chứa AgCl c mol và Ag.
![]()
Do cho AgNO3 vào sinh ra 0,03 mol NO nên H+ dư 0,12 mol.
Bảo toàn e kết hợp bảo toàn điện tích:
c = 0,04 + 8b + 0,06.2 + 0,08.3 + 0,06.8 + 0,04.8 + 0,12
Bảo toàn e:
![]()
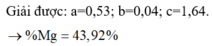

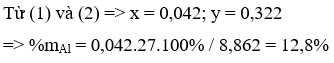
Gọi nMg = a mol ; nAl = b mol
=> 24a + 27b = 1,86 (I)
nN2O = 0,56 ; 22,4 = 0,025 mol
Áp dụng ĐLBT e , ta có
\(Mg^0-2e->Mg^{2+}\)
..a...........2a
\(Al^0-3e->Al^{3+}\)
..b........3b
\(N^{5+}+2.4e->N^{1+}\)
..............0,2.......0,025
=> 2a + 3b = 0,2 (II)
Giải (I) & (II) ta đc : a = 0,01 ; b = 0,06
=> mMg = 0,01 . 24 = 0,24 g