Cho 6,48g hỗn hợp Fe, FeO , Fe2O3 thành 2 phần bằng nhau
Phần 1 : Cho vào cốc đựng lượng dư dd CuSO4 sau phản ứng hoàn toàn thấy lượng trong cốc có 3,32g chất rắn
Phần 2 : Hòa tan bằng dd HNO3 loãng dư thu được dd A và 0,336 lít NO duy nhất ở đktc . Tính khối lượng mỗi chất trong hỗn hợp ban đầu

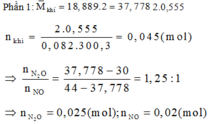

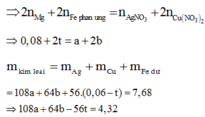
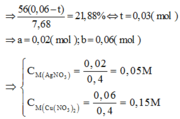

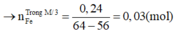

Gọi số mol của Fe; FeO; Fe2O3 trong hh ban đầu là: 2x; 2y; 2z
\(n_{NO}=0,015\left(mol\right)\)
Ta có: \(\text{ 56x+72y+ 160z= 3.24 (1)}\)
PTHH:
\(\text{Fe + CuSO4 → FeSO4 + Cu↓}\)
x_______________________x
\(\text{Fe + 4HNO3→ Fe(NO3)3 + NO+ 2H2O}\)
x________________________x
\(\text{3FeO + 10HNO3→ 3Fe(NO3)3 + NO+ 5H2O}\)
y_____________________________\(\frac{y}{3}\)
\(\text{Fe2O3+ 6HNO3→ 2Fe(NO3)3 + 3H2O}\)
Nên : 3,32 g chấy rắn là: Cu ; FeO; Fe2O3⇒\(\text{ 64x+ 72y+ 160z= 3,32 (2) }\)
Ta lại có: \(x+\frac{y}{3}=0,015\left(3\right)\)
⇒ Từ (1); (2); (3) ta được: x=0,01 ; y= 0,015; z= 0,01 mol
⇒ \(\text{mFe = 0,02 .56= 1,12 g}\)
\(\text{ mFeO= 0,03 . 72=2,16 g}\)
\(\text{mFe2O3 = 0,02 .160=3,2 g}\)