Hiệu ứng nhiệt của quá trình cho 0,01kg Na pu với nước lấy rất dư là 79910J.Hiệu ứng nhiệt của quá trình cho 0,02 kg Na2O pư với nước lấy rất dư là 76755J.Tính nhiệt tạo thành tiêu chuẩn của Na2O ,biết rằng thiêu nhiệt của H2 là -285,84 kJ/mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.

Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với n Fe = 2 n Al 2 O 3 . Chia thành 2 phần không bằng nhau:
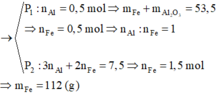

Đáp án: D
- Gọi Q 1 là nhiệt lượng nược thu vào để tăng nhiệt độ từ t 1 = - 10 0 C đến t 2 = 0 0 C :
Q1 = m1.c1.( t2 – t1) = 5.1800.[0 – (-10)]= 90000 (J) = 90 (kJ)
- Nhiệt lượng nước đá thu vào để nóng chảy hoàn toàn ở 0 0 C :
![]()
- Nhiệt lượng cần thiết cho cả quá trình là:
![]()

+ Nhiệt lượng tỏa ra khi ngưng tụ hơi nước ở 1000C thành nước ở 1000C: Q 1 = L m 1 = 0 , 01 L
+ Nhiệt lượng tỏa ra khi nước ở 1000C thành nước ở 400C:
Q 2 = m c ( 100 - 40 ) = 0 , 01 . 4180 100 - 40 = 2508 J
=>Nhiệt lượng tỏa ra khi hơi nước ở 1000C biến thành nước ở 400C: Q = Q 1 + Q 2 = 0 , 01 L + 2508
+ Nhiệt lượng cần cung cấp để 0,2kg nước từ 9,50C thành nước ở 400C: Q 3 = 0 , 2 . 4180 40 - 9 , 5 = 25498 J
(2)
=>Theo phương trình cân bằng nhiệt: (1) = (2).
Vậy 0 , 01 L + 2508 = 25498 .
Suy ra: L = 2 , 3 . 10 6 J / k g .
Đáp án: C

a)nKClO3=\(\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH: 2KClO3\(\underrightarrow{t^o}\)2KCl +3O2
0,2 0,3 (mol)
VO2=\(0,3.22,4=6,72\left(l\right)\)
b) nNa=\(\dfrac{9,2}{23}=0,4\left(mol\right)\)
PTHH: 4Na +O2\(\rightarrow\) 2Na2O
4 1 2 (mol)
Có: \(\dfrac{0,4}{0,15}< \dfrac{4}{1}\)\(\Rightarrow0,4< 0,6\)
=> O2 dư. => Tính theo Na.
PTHH: 4Na +O2\(\rightarrow\) 2Na2O
0,4 0,2 (mol)
mNa2O= \(0,2.62=12,4\left(g\right)\)
Đáp số: a) 6,72 l.
b) 12,4g.

\(Q_{thu}=m_{nuoc}.c_{nuoc}.\left(t_{cb}-t_n\right)=0,2.c_n\left(40-9,5\right)\)
\(Q_{toa}=m_{hoinuoc}.c_{nuoc}.\left(100-40\right)+m_{hoinuoc}.L\)
\(Q_{thu}=Q_{toa}\Leftrightarrow0,2.4180.\left(40-9,5\right)=\left(100-40\right).4180.0,01+0,01.L\)
\(\Rightarrow L=2299000\left(J/kg\right)\)

a)ta có phương trình cân bằng nhiệt:
m1C(t1-t)=m2C(t-t2)
\(\Leftrightarrow DV_1C\left(t_1-t\right)=DV_2C\left(t-t_2\right)\)
do cả hai chất đều là nước nên:
V1(t1-t)=V2(t-t2)
\(\Leftrightarrow2\left(80-t\right)=3\left(t-20\right)\)
giải phương trình ta có:
t=44 độ C
b)ta có:
nhiệt lượng nước ở 20 độ C thu vào là:
Q2=m2C(t-t2)
\(\Leftrightarrow Q_2=DV_2\left(t-t_2\right)\)
nhiệt lượng nước ở 80 độ C:
Q1=m1C(t1-t)
\(\Leftrightarrow DV_1C\left(t_1-t\right)\)
hiệu suất trao đổi nhiệt là:
\(\frac{Q_2}{Q_1}100=20\%\)
\(\Leftrightarrow\frac{DV_2C\left(t-t_2\right)}{DV_1C\left(t_1-t\right)}100=20\%\)
do cả hai chất đều là nước nên:
\(\frac{V_2\left(t-t_2\right)}{V_1\left(t_1-t\right)}100=20\%\)
\(\Leftrightarrow\frac{3\left(t-20\right)}{2\left(80-t\right)}100=20\%\)
giải phương trình ta có:
t=20 độ C

Hiệu ứng nhiệt khi cho 0,01 kg Na phản ứng với H2O là 79910J
(1 mol) 0,023 kg__________________183793J = 183,793 kJ
Hiệu ứng nhiệt khi cho 0,02 kg Na phản ứng với H2O là 76755J
(1 mol) 0,062 kg_________________237940,5J = 237,9405 kJ
\(\text{(1) Na + H2O → NaOH + 0,5 H2____________ ΔH1 = 183,793 kJ/mol}\)
\(\text{(2) Na2O + H2O → 2NaOH_____________ ΔH2 = 237,9405 kJ/mol}\)
\(\text{(3) H2 + 0,5 O2 → H2O ______________ ΔH3 = -285,84 kJ/mol}\)
\(\text{(4) 2Na + 0,5 O2 → Na2O_____________ ΔH4 = ?}\)
Ta thấy: (4) = 2.(1) - (2) + (3)
→ ΔH4 = 2.ΔH1 - ΔH2 + ΔH3
= 2.183,793 - 237,9405 + (-285,84)
= -156,1945 kJ/mol