Câu 3: 4,6gam kim loại kiềm R tác dụng hết với 75,6 gam H2O thu được dung dịch có nồng độ chất tan là 10%. Tìm R?
Câu 4: Hỗn hợp X gồm 2 muối cacbonat của hai kim loại kiềm thuộc 2 chu kì kế tiếp. Cho 18 gam hh X tác dụng với dung dịch HCl dư thu được 4,48 lít khí CO2(đktc). Xác định tên 2 kim loại kiềm?
Câu 5: Hoà tan một oxit kim loại hoá trị II bằng một lượng vừa đủ dung dịch H2SO4 10% thu được dung dịch muối có nồng độ 15,17%. Tìm công thức oxit của kim loại đó?

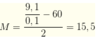

Câu 5
Gọi kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4 -> MSO4 + H2O
C% = \(\frac{m_{ct}}{m_{dd}}\) . 100%
10% = \(\frac{98}{mdd}\) . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = (M + 96) / (M + 996) .100%
M = 64.95 g
M là Zn
Công thức oxit ZnO
#tham khảo nhưng mình đã sửa lại cho dễ hiểu rồi nhé
Câu 4:
\(\text{Gọi công thức chung của 2 kim loại kiềm là X}\)
\(\text{=> ct muối là X2CO3}\)
\(\text{X2CO3 + 2HCl -> 2XCl + CO2 + H2O}\)
-> n X2CO3 = n CO2 = 0.2
Công thức tính khối lượng : M = m/n Hay 2X + 60 = 18 : 0.2
-> X =15
\(\text{Bài dựa vào bth tìm 2 nguyên tố có ntk gần 15 là đc}\)