Đốt cháy hoàn toàn 6,2 gam P trong oxi dư . Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4
a ) Tính khối lượng dung dịch NaOH đã dùng
b) Tính nồng độ % của muối trong dung dịch thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

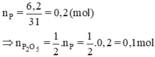
Theo pt: nNaOH = 4. nP2O5 = 4. 0,1 = 0,4 mol
Khối lượng NaOH = 0,4. 40 = 16 g
Khối lượng dung dịch NaOH = 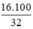 = 50,0 g
= 50,0 g

Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
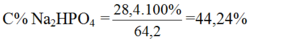

a, (1) 4P+5.O2->2.P2O5
(2) P2O5+4.NaOH->2.Na2HPO4+H2O
b, photpho có n=6,2:31=0,2 mol.dựa theo pt (1) thấy nP2O5=0,1mol.theo pt (2) thấy nNaOH=0,4mol vậy mNaOH=0,4.40=16 g vậy m(dd NaOH)=16:32%=50 g
c, theo pt (2) nNa2HPO4 =0,2 mol vậy mNa2HPO4=0,2.142=28,4 g
m(dd sau pư)=mP+m(dd NaOH)=6,2+50=56,2 g
=> C%(dd Na2HPO4)=28,4:56,2=50,53%

Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
a) 4P+5O2--->2P2O5
P2O5+4NaOH----->2 Na2HPO4+H2O
n\(_P=\frac{6,2}{32}=0,2\left(mol\right)\)
Theo pthh1
n\(_{P2O5}=\frac{1}{2}n_P=0,1\left(mol\right)\)
Theo pthh2
n\(_{NaOH}=4n_{P2O5}=0,4\left(mol\right)\)
mdd NaOH=\(\frac{0,4.40.100}{32}=50\left(g\right)\)
b) m dd sau pư=50+0,1.142=192(g)
Theo pthh
n\(_{Na2HPO4}=2n_{P2O5}=0,2\left(mol\right)\)
C%=\(\frac{0,2.142}{192}.100\%=14,79\%\%\)
\(\text{nP = 6,2 : 31 = 0,2 mol}\)
PTHH: 4P + 5O2 --t^o--> 2P2O5
.............0,2 ---------------------> 0,1 (mol)
P2O5 + 3H2O -> 2H3PO4
0,1 -----------------> 0,2 (mol)
H3PO4 + 2NaOH -> Na2HPO4 + 2H2O
0,2---------> 0,4 ----> 0,2.......................... (mol)
\(\text{a) mNaOH = 0,4.40 = 16 gam}\)
\(\Rightarrow\text{m dd NaOH = 16.(100/32) = 50 gam}\)
\(\text{b) m dd sau pư = mP2O5 + m dd NaOH = 0,1.142 + 50 = 64,2 gam}\)
\(\Rightarrow\text{C% Na2HPO4 =}\text{44,24%}\)