Hẫy xác định công thức muối nảti cacbonat ngậm nuớc biềt rằng khi nung 3.1 g tinh thể này đến m ko đổi dc chất rắn có khối lượng là 2,65g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt CTPT của muối cacbonat ngậm nước là:

Vậy CTPT của muối cacbonat ngậm nước là Na 2 CO 3 . H 2 O
Đáp án: A

Đáp án C
Vì muối đem nhiệt phân là muối nitrat của kim loại và sản phẩm thu được có hỗn hợp khí nên hỗn hợp khí này chứa NO2 và O2.
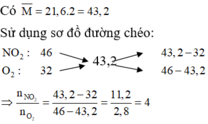
Do đó khi nhiệt phân muối nitrat của M ta thu được oxit kim loại với hóa trị của M trong muối và trong oxit kim loại là như nhau. Căn cứ vào các đáp án thỏa mãn là A, C và D thì công thức của muối có dạng M(NO3)2.
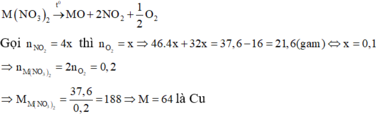

a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)

Gọi y, x lần lượt là số mol NaHCO3 và Na2CO3
Theo bài ra ta có hệ
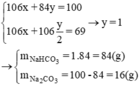
Thành phần % theo khối lượng các chất
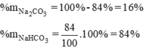
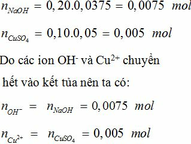

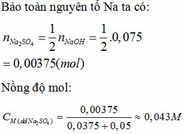
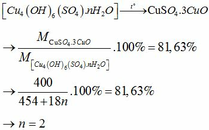

Na2CO3.xH2O-----> Na2CO3
mH2O = 3,1 -2,65 = 0,45 (g)
nNa2CO3 = 2,65/106 =0,025 (mol);
nH2O = 0,45/18 = 0,025 (mol)
Tỉ lệ mol: Na2CO3 : H2O trong tinh thể là: 1:1
Công thức muối ngậm nước là : Na2CO3.H2O