Trôn V1 lít dung dịch HCl 0,6M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A . Tính V1,V2 biết 0,6 lít dung dịch A có thể hòa tan hêta 1,02 g Al2O3
Mấy bạn giải chi tiết hộ mình , cảm ơn trước
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl=0,6V1 mol; n NaOH=0,4V2 mol
Do dd A có thể hòa tan Al2O3=> HCl hoặc NaOH dư
*TH1: HCl dư
Al2O3+6HCl-> 2AlCl3+3H2O nAl2O3=0,01 mol=> nHCl dư =0,06 mol
nHCl phản ứng= n NaOH=0,4V2 mol=>n HCl dư = 0,6V1-0,4V2=0,06 mol
V1+V2=0,6l
giải hpt ra V1=V2=0,3l
*TH2: NaOH dư
2NaOH+Al2O3-> 2NaAlO2+H20 (3)
n NaOH dư=2nAl2O3=0,02 mol
=>nNaOH dư= 0,4V2-0,6V1=0,02 mol
V1+V2=0,6l
giải hpt ra V1=0,22l, V2=0,38l

$n_{HCl} = 0,6V_1(mol) ; n_{NaOH} = 0,4V_2(mol)$
$V_1 + V_2 = 0,6(1)$
TH1 : HCl dư
$n_{HCl\ dư} =0,6V_1 - 0,4V_2 (mol)$
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2$
$n_{HCl\ dư} = 6n_{Al_2O_3} = 0,12(mol)$
$\Rightarrow 0,6V_1 - 0,4V_2 = 0,12(2)$
Từ (1)(2) suy ra $V_1 = 0,36(lít) ; V_2 = 0,34(lít)$
TH2 : NaOH dư
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1(mol)$
$2NaOH + Al_2O_3 \to 2NaAlO_2 + H_2O$
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1 = 2n_{Al_2O_3} = 0,04(3)$
Từ (1)(3) suy ra $V_1 = 0,2(lít) ; V_2 = 0,4(lít)$
AlO3 là chất gì em ha? Hay là Al2O3
Em xem lại đề em nha!

a) mHCl(ddC)= 9,125+ 5,475= 14,6(g) => nHCl= 0,4(mol)
CMddHCl(ddC)= 0,4/2=0,2(M)
b) Gọi a,b lần lượt là thể thích dd HCl A và dd HCl B. (a,b>0) (lít)
nHCl(ddA)= 0,25(mol); nHCl(ddB)=0,15(mol)
Tổng thể tích ddA và dd B bằng thể tích ddC:
=>a+b=2(1)
Mặt khác: CMddA - CMddB=0,4
<=> 0,25/a - 0,15/b=0,4 (2)
Từ (1), (2) ta giải được: a=0,5 ; b=1,5
=> CMddA= 0,25/0,5=0,5(M)
CMddB=0,15/1,5=0,1(M)

Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2

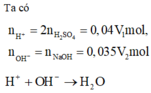
Để thu được dung dịch có pH = 2 chứng tỏ dung dịch sau phản ứng chứa axit dư [H+] dư = 0,01 M
→ nH+(du) = 0,04V1-0,035V2 = 0,01.(V1 + V2) → 0,03V1 = 0,045V2 → V1 : V2 = 3:2
Đáp án B
NaOH + HCl ---> NaCl + H2O
0.6V1_0.4V2_
Có: V1 + V2 = 0,6 (1)
nAl2O3 = 0,01mol
TH1: HCl dư
6HCl + Al2O3 ---> 2AlCl3 + 3H2O
0.06___0.01_
=> nHCldư = 0.4V2 - 0.6V1 = 0.06 (2)
Từ (1); (2) => V1 = 0.18; V2 = 0.42
TH2: NaOH dư
2NaOH + Al2O3 ---> 2NaAlO2 + H2O
__0.02___0.01_
=> nNaOH dư = 0.6V1 - 0.4V2 = 0.02 (3)
Từ (1); (3) => V1 = 0.26; V2 = 0.34
nAl2O3 = 0.1
nHCl = 0.6V1
nNaOH = 0.4V2
TH1: HCl dư
NaOH + HCl = NaCL + H2O
0.4V2----0.4V2
Al2O3 + 6HCl = 2AlCl3 + 3H2O
0.1----------0.6
có 0.6 = 0.6V1 - 0.4V2
V1 + V2 = 0.6
=> loại
TH2 : NaOH dư
NaOH + HCl = NaCL + H2O
0.6V1----0.6V1
2NaOH + Al2O3 = 2NaALO2 + H2O
0.2------------0.1
0.2 = 0.4V2 - 0.6V1
V1 + V2 = 0.6
=> V1 = 0.04,V2 = 0.56