Trộn 5,4g Al với 12,0 gam Fe2O3 rồi nung nóng một thời gian để thực hiện phản ứng nhiệt nhôm. Sau phản ứng ta thu được m g hỗn hợp chất rắn. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Al + X\(\rightarrow\) rắn
BTKL:
m rắn thu được=mAl+mX
= 2,7+15=17,7 gam
2Al+Fe2O3--->2Fe+Al2O3
Chất rắn sau pư gồm Fe và FeO
n Al=2,7/27=0,1(mol)
n Fe2O3=1/2n Al=0,05(mol)
m Fe2O3=0,05.160=8(g)
m FeO=15-8=7(g)
n Fe=n Al=0,1(mol)
m Fe=0,1.56=5,6(g)

Khá nhiều bạn sẽ rập khuôn cách giải sau: n A l = 1 15
Ta có phản ứng:
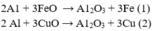
Đặt
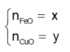
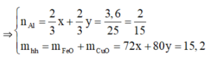
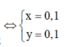
Từ (1) và (2) suy ra
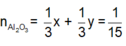
![]()
n F e = x = 0 , 1 = > m F e = 0 , 1 . 56 = 5 , 6 g
n C u = y = 0 , 1 = > m C u = 0 , 1 . 64 = 6 , 4 g
m = m A l 2 O 3 + m F e + m C u = 6,8 + 5,6 + 6,4 = 18,8 g
Đáp án A.


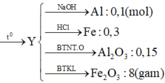
2Al +Fe2O3---.2Fe +Al2O3
Ta có
n\(_{Al}=\frac{5,4}{27}=0,2\left(mol\right)\)
n\(_{Fe2O3}=\frac{12}{160}=0,075\left(mol\right)\)
=>Al dư
Theo pthh
n\(_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\)
=>m\(_{Fe}=0,15.56=8,4\left(g\right)\)
Theo pthh
n\(_{Al2O3}=n_{Fe2O3}=0,075\left(mol\right)\)
m\(_{Al2O3}=0,075.102=7,65\left(g\right)\)
Theo pthh
n\(_{Al}=2n_{Fe2O3}=0,15\left(mol\right)\)
m\(_{Al}=0,15.27=4,05\left(g\right)\)
m\(_{Al}dư=5,04-4,05=0,99\left(g\right)\)
m=0,99+7,65+8,4=17,04(g)
Chúc bạn học tốt