cho m gam na2o tác dụng với dung dịch chứa 0,3 mol h2so4 phản ứng hóa toàn thu được dung dịch A dung dịch A hòa tan tối đa 0,05 mol al2o3 . tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D.
![]()
![]()
- Khi cho dung dịch Z tác dụng với BaCl2 dư thì : ![]()
- Xét quá trình hỗn hợp X tác dụng với dung dịch Y ta có :
![]()
![]()
![]()
- Khi dung dịch Z tác dụng với 0,935 mol NaOH thì: ![]()
![]()
![]()
![]()
![]()
![]()

Ta có nNaOH = 0,006 mol ; nH2SO4 = 0,028 mol
=>nH2SO4 phản ứng X = 0,05 mol = nX
=>các amino axit trong X chỉ chứa 1 nhóm NH2.
+/ Xét ½ X có số mol 0,025 . nBa(OH)2 = 0,015 mol
=>Lượng OH- trung hòa ½ X là 0,03 mol > 0,025
=>Trong X có 1 amino axit có 1 nhóm COOH ; axit còn lại có 2 nhóm COOH
=> naa có 2 nhóm COOH = 0,005 mol ; naa có 1 nhóm COOH = 0,02 mol
Đặt CT 2 amino axit là R1(NH2)(COOH) ; R2(NH2)(COOH)2
=>Tạo muối với Ba(OH)2 và nH2O = nOH- = 0,03 mol
Bảo toàn Khối lượng : m1/2 X= 2,235g
=> 0,02.( R1 + 61) + 0,005.(R2 + 106) = 2,235
=> 4R1 + R2 = 97
=>R1 = 14 (CH2) và R2 = 41 ( C3H5) TM
=> Do MB > MA => B là NH2-C3H5-(COOH)2
=>%mM(X) = 32,89%
=>D

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
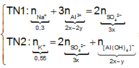
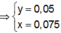
![]() thỏa mãn
thỏa mãn
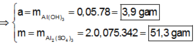
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
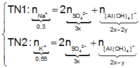
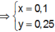
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.



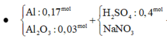
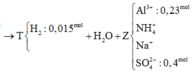
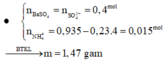
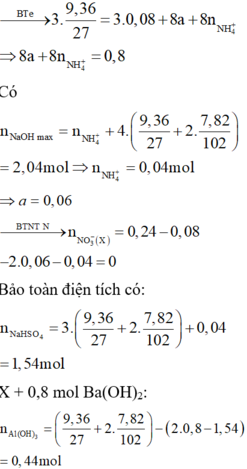
đơn giản vậy thôi hả bạn