Tính nồng độ mol/l của các ion trong các trường hợp sau :
a/ Dung dịch CH3COOH 0,01M , độ điện li \(\alpha=4,25\%\)
b/ Dung dịch CH3COOH 0,1M , độ điện li \(\alpha=1,34\%\)
c/ Dung dịch CH3COOH 0,1M . Cho Ka = 1,8 .10-5
HELP ME !!!!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CH3COOH ⇄ H+ + CH3COO-
Do phân li không hoàn toàn → [H+] < 0,1M
Đáp án D

Chọn đáp án B
CH3COOH là chất điện li yếu: CH3COOH ⇄ CH3COO– + H+
⇒ [H+] = [CH3COO–] = [CH3COOH]điện li < [CH3COOH]ban đầu = 0,1M

Chọn đáp án B
CH3COOH là chất điện li yếu: CH3COOH ⇄ CH3COO– + H+
⇒ [H+] = [CH3COO–] = [CH3COOH]điện li < [CH3COOH]ban đầu = 0,1M
⇒ chọn B.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
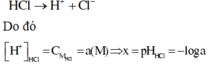
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
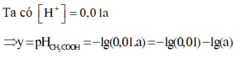
![]()
Đáp án A.

Đáp án A
Các dẫn điện tốt (chất điện li mạnh) là các muối, axit mạnh, bazo mạnh. → Trong các chất trên, NaCl là muối; CH3COOH là axit yếu, NH3 là bazo yếu, C2H5OH là ancol → NaCl là chất điện li mạnh → NaCl là chất dẫn điện tốt nhất.