Tính C% của 1 dung dịch H2SO4 nếu biếu rằng khi cho 1 lượng dung dịch này tác dụng với lượng dư hỗn hợp Na- Mg thì lượng H2 thoát ra bằng 4,5% khối lượng dung dịch axit đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=0,5\cdot1=0,5mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 1,5y 0,5y 1,5y
\(\Rightarrow\left\{{}\begin{matrix}24x+27y=7,8\\x+1,5y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-\dfrac{1}{2}\left(n_oâm\right)\\y=\dfrac{7}{15}\end{matrix}\right.\)
Em kiểm tra lại đề nha!!!

- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)

Coi lượng dung dịch axit đã dung = 100g thì lượng H2 thoát ra = 4,5g
+ 2Na + H2SO4 \(\Rightarrow\) Na2SO4 + H2
+ Mg + H2SO4 \(\Rightarrow\) MgSO4 + H2
+ 2Na + H2O \(\Rightarrow\)NaOH + H2
Theo PTPƯ lượng H2 = lượng H của H2SO4 + 1/2 lượng H của H2O
Do đó, nếu coi lượng axit = x g , ta có:
x / 98 . 2 + 100 - x / 18 = 4,5
\(\Rightarrow\) x = 30
Giả sử khối lượng dung dịch =100 g
-> khối lượng khí bay ra=4,5 g
PTPƯ :
2Na + H2SO4 -> Na2SO4 + H2
Mg + H2SO4->MgSo4 + H2
2Na + 2H2O->2NaOh + H2
2NaOH + MgSo4->Na2SO4 + Mg(OH)2
theo PT 1,2 : n H2 = n H2SO4 =a mol
PT 3: n H2 =0,5 n H2O=0,5b
-> tổng n H2 =a + 0,5 b=2,25 (mol)
mà m dung dịch =100 g-> 98 a + 18b =100 (g)
giải hệ pt
=> a= 0,3 b= 3,9
=> m H2SO4 = 29,4
=> C% =30,03%

Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
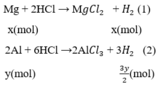
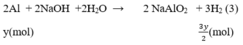
Số mol H2
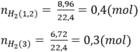
Theo bài ra ta có hệ phương trình:
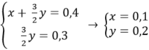
mMg = 24.0,1 = 2,4(g)
mAl = 27.0,2 = 5,4(g)

Bài 1:
\(n_{H_2SO_4}=\dfrac{200.14,7\%}{98}=0,3\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\\ m_{Al_2\left(SO_4\right)_3}=342.0,1=34,2\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=n_{H_2}=0,15\left(mol\right)\\ \Rightarrow m_{Mg}=0,15.24=3,6\left(g\right)\\ \%m_{Mg}=\dfrac{3,6}{10}.100=36\%\\ \%m_{Cu}=100\%-36\%=64\%\)
Gọi m dung dịch = 100 g
=> m khí bay ra = 4,5 g
2Na + H2SO4 -> Na2SO4 + H2
Mg + H2SO4->MgSo4 + H2
2Na + 2H2O->2NaOh + h2
2NaOH + MgSo4 -> Na2SO4 + Mg(OH)2
Theo PT 1,2 : n H2 = n H2SO4 = a mol
PT 3: n H2 =0,5 n H2O=0,5b
-> tổng n H2 =a + 0,5 b=2,25 (*)
mà m dung dịch =100 g-> 98 a + 18b =100 (*')
giải hệ pt a=19/62
-> m H2SO4 = ...
-> C% =30,03%