Bài 1/Từ 320 tấn quặng pirit sắt FeS2 có chứa 45% lưu huỳnh đã sản xuất được 450 tấn axit sunfuric. Hãy xác định hiệu suất của quá trình sản xuất.
Bài 2/ Từ 1 tấn quặng pirit sắt chứa 80% FeS2 có thể điều chế được bao nhiêu tấn dung dịch HsSO4 60%? Biết rằng sự hao hụt trong sản xuất là 5%

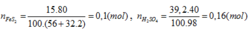

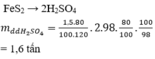
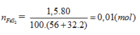
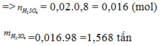

\(PTHH:S+O_2\underrightarrow{t^o}SO_2\\ SO_2+\frac{1}{2}O_2\xrightarrow[V_2O_5]{t^o}SO_3\\ SO_3+H_2O\rightarrow H_2SO_4\)
\(m_{S\cdot trong\cdot FeS_2}=320.10^6.45\%=144.10^6\left(g\right)\)
\(n_S=\frac{144.10^6}{32}=45.10^5\left(mol\right)\)
Theo pt: \(n_S=n_{SO_2}=n_{SO_3}=n_{H_2SO_4}\)
\(\Rightarrow n_{H_2SO_4}=45.10^5\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=45.10^5.98=441.10^6\left(g\right)=441\left(ton\right)\)
\(H=\frac{441}{450}.100\%=98\left(\%\right)\)
Đề bài 1 có bị nhầm khối lượng axit sunfuric k đấy bạn? ._.