Bài tập tóm tắt và ghi nhớ kiến thức cơ bản
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1Nghĩa của từ:nghĩa của từ là nội dung mà từ biểu thị.
2. Cách giải thích nghĩa của từ
Người ta có thể giải thích nghĩa của từ bằng các cách sau đây :
+ Trình bày khái niệm mà từ biểu thị
Ví dụ : – Danh từ là những từ chỉ người, chỉ loài vật, cây cối, đồ vật,…
– Động từ là những từ chỉ hoạt động, trạng thái của người, của sự vật. ‘
– Tính từ là những từ chỉ tính chất như màu sắc, kích thước, hình thể, phẩm chất,…
+ Quan liêu là những người cán bộ phụ trách nhưng xa rời thực tế, xa rời quần chúng.
+ Chạy là hoạt động dời chỗ bằng chân của người hoặc động vật với tốc độ cao.
– Dùng từ đồng nghĩa hoặc trái nghĩa với từ mà mình giải thích.
Ví dụ : +Tổ quốc là đất nước mình.
+ Cao là số đo chiều thẳng đứng, đối lập với thấp.
+ Dài là số đo chiều nằm ngang, đối lập với ngắn.
+ Bấp bênh là không vững chắc.
3. Dùng từ đúng nghĩa
Muốn dùng từ đúng nghĩa trước hết ta phải nắm vững được nghĩa của từ. Thông thường một từ có rất nhiều nghĩa.
Ví dụ : Từ ăn có 13 nghĩa, từ chạy có 12 nghĩa, từ đánh có 27 nghĩa.
Vì thế muốn hiểu đúng nghĩa của từ ta phải đặt từ trong câu cụ thể. Do sự kết hợp giữa các từ trong câu mà nghĩa cụ thể của từ được bộc lộ. Ta cũng có thể tra từ điển để nắm được nghĩa của từ. Cách tốt nhất là đạt từ trong câu cụ thể.
Ví dụ : Trong các câu :
-Tôi ăn cơm.
Từ ăn có nghĩa là hoạt động đưa thực phẩm vào dạ dày.
– Tôi đi ăn cưới.
Từ ăn có nghĩa là ăn uống nói chung, nhân dịp lễ thành hôn.
– Họ ăn hoa hồng.
Từ ăn có nghĩa là nhận lấy để hưởng.
Chúng ta phải luôn luôn học hỏi, tìm tồi để hiểu đúng nghĩa của từ, tập nói, tập viết thường xuyên. Khi nói, khi viết phải lựa chọn và phải kết hợp một cách thành thạo các từ, nhất là khi gặp một từ có nhiều từ đồng nghĩa thì phải cân nhắc một cách cẩn thận.
Ví dụ : chết, mất, toi, qua đời, từ trần, hi sinh.
Muốn hiểu đúng nghĩa của từ ta phải liên hội được quan hệ giữa từ với sự vật, hoạt động, trạng thái, tính chất mà từ biểu thị. Từ đó chỉ ra những đặc điểm, những thuộc tính của sự vật, hoạt động, trạng thái, tính chất,… mà từ biểu thị.

- Truyện hiện đại:là truyện có những đổi mới, những điều mà các loại truyện đó ko có.
cách tóm tắt truyện:
Bước 1: Đọc hiểu và xác định nội dung chính của văn bản đó (hay chủ đề và tư tưởng của văn bản.
Bước 2: Xác định các nhân vật chính và các sự kiện gắn liền với nhân vật chính.
Bước 3: Sắp xếp các dữ liệu đã thu thập được theo trình tự trong tác phẩm
cách viết bài cảm nhận về nhân vật:
1.Ý khái quát : Vài nét về tác giả tác phẩm, hoàn cảnh sáng tác, nội dung chính của tác phẩm.
2.Phân tích nhân vật theo yêu cầu đề. Có thể chia nhỏ thành các luận điểm : + Cuộc đời, Số phận, hoàn cảnh gia đình. + Ngoại hình. + Tài năng. ...
3.Đánh giá về nhân vật
mik chỉ làm đc như v
phần còn lại mik gửi link cho

Lần sau đăng câu hỏi chia nhỏ ra nhé em !
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học: Viết PT minh họa cho mỗi t/c
a. Tác dụng với phi kim
PTHH: S + O2 ----to-----> SO2
PTHH: 4P + 5O2 ----to-----> 2P2O5
b. Tác dụng với kim loại
PTHH: 3Fe + 2O2 ----to-----> Fe3O4
c. Tác dụng với hợp chất:
CH4 + 2O2 ----to-----> CO2 + H2O
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa là gì?
Là sự tác dụng của oxi với một chất
2. Phản ứng hóa hợp là gì?
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng cần nâng nhiệt độ lên để khơi mào phản ứng lúc đầu, các chất sẽ cháy, tỏa nhiều nhiệt gọi là phản ứng tỏa nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha nguyên tố , trong đó có một nguyên tố là oxi
VD: sắt từ oxi Fe3O4, lưu huỳnh đioxi SO2,…
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit
Vd : SO3 tương ứng với axit H2SO4
CO2 tướng ứng với axit H2CO3
b. Oxit bazo
Thường là oxit của kim loại và tương ứng với một bazơ
VD: MgO tương ứng với bazo Mg(OH)2
K2O tương ứng với KOH
3. Cách gọi tên:
Tên oxit = tên nguyên tố + oxit
- Nếu kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
VD: FeO : sắt (II) oxit
Fe2O3 : sắt (III) oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một
+ Đi : hai
+ Tri : ba
+ Tetra : bốn
+ Penta : năm
VD: CO: cacbon monooxit
CO2: cacbon đioxit
SO2: lưu huỳnh đioxit
SO3: lưu huỳnh trioxit
P2O3: điphotpho trioxit
P2O5 : đi photpho pentaoxit
4. công thức :
- CT chung M2Ox với x là hóa trị của chất M
- Nếu x = 2 thì có công thức là MO
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi Trong phòng thí nghiệm. viết PT minh họa
Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo PT:
2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
2. Phản ứng phân hủy là gì? Cho vd
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Thành phần của Không khí
a. Thành phần chính
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cự thể oxi chiếm 21% thể tích, phần còn lại hầy hết là nitơ
b. Thành phần khác
Các khí khác (hơi nước, CO2, khí hiếm, bụi khói,…) chiếm tỉ lệ rất nhỏ, chỉ khoảng 1%
2. Sự cháy và sự oxi hóa chậm
a. Sự cháy
- Là sự oxi hóa có tỏa nhiệt và phát sáng
- Sự khác nhau giữa sự cháy trong oxi và trong không khí: cháy trong không khí diễn ra chậm hơn, tạo nhiệt độ thấp hơn trong oxi. Do trong không khí còn có nito với thể tích gấp 4 lần oxi, làm diện tích tiếp xúc của vật với oxi ít nên sự cháy diễn ra chậm hơn. Đồng thời, nhiệt tiêu hao còn dùng để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn
b. Sự oxi hóa chậm
- Là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
- VD: sắt để lâu trong không khí bị gỉ
- Trong điều kiện nhất định, sựu oxi hóa chậm có thể chuyển thành sự cháy
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro
1. Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học: viết PT minh họa
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
II. Điều chế khí Hiđrơ - Phản ứng thế
1. Điều chế hidrô Trong phòng thí nghiệm
Cho kim loại (Al, Fe, ….) tác dụng với dung dịch axit (HCl, H2SO4).
Khí H2 được thư bằng cách đẩy không khí hay đẩy nước. nhận ra khí H2 bằng que đóm đang cháy ( cháy trong không khí với ngộn lửa xanh nhạt) hoặc dùng tàn đóm ( không làm tàn đóm bùng cháy)
VD: Fe + 2HCl → FeCl2 + H2
2. Phản ứng thế
Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
VD: Fe + 2HCl → FeCl2 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
III. Nước
1. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị
Sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C
Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít)
Có thể hòa tan được nhiều chất rắn ( muối ăn, đường,…), chất lỏng ( còn, axit), chất khí (HCl,…)
2. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối
Nêu khái niệm, CTHH; phân loại; cách gọi tên các hợp chất và cho vd
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,….
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
H2S: axit sunfuhidric. Gốc axit tương ứng là sunfua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
HNO3: axit nitric. Gốc axit: nitrat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazo gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n , n: số hóa trị của kim loại
c. Tên gọi:
Tên bazo = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hidroxit
VD: Fe(OH)2: sắt (II) hidroxit
KOH: kali hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hidro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hidro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…

Thams khảo:
Xã hội phong kiến phương Đông:
- Thời kỳ hình thành: Từ thế kỷ III trước Công nguyên đến khoảng thế kỷ X, từ rất sớm.
- Thời kỳ phát triển: từ thế kỷ X đến XV, phát triển khá chậm.
- Thời kỳ khủng hoảng: từ thế kỷ XVI đến XIX và kéo dài suốt 3 thế kỉ.
- Cơ sở kinh tế: nông nghiệp đóng kín trong công xã nông thôn.
- Giai cấp cơ bản: địa chủ và nông dân lĩnh canh (bóc lột thông qua tô thuế).
- Thế chế chính trị: quân chủ.
Xã hội phong kiến phương Tây (châu Âu):
- Thời kỳ hình thành: từ thế kỉ V đến thế kỉ X, hình thành muộn, sau Xã hội phong kiến phương Đông.
- Thời kỳ phát triển: từ thế kỷ XI đến XIV, phát triển rất phồn thịnh .
- Thời kỳ khủng hoảng: từ thế kỷ XV đến XVI, kết thúc sớm và bắt đầu chuyển sang chủ nghĩa tư bản.
- Cơ sở kinh tế: Nông nghiệp đóng kín trong lãnh địa.
- Giai cấp cơ bản: Lãnh chúa và nông nô (bóc lột thông qua tô thuế).
- Thế chế chính trị: Quân chủ.
Xã hội phong kiến phương Đông: - Thời kỳ hình thành: Từ thế kỷ III trước Công nguyên đến khoảng thế kỷ X, từ rất sớm. - Thời kỳ phát triển: từ thế kỷ X đến XV, phát triển khá chậm. - Thời kỳ khủng hoảng: từ thế kỷ XVI đến XIX và kéo dài suốt 3 thế kỉ. - Cơ sở kinh tế: nông nghiệp đóng kín trong công xã nông thôn. - Giai cấp cơ bản: địa chủ và nông dân lĩnh canh (bóc lột thông qua tô thuế). - Thế chế chính trị: quân chủ. Xã hội phong kiến phương Tây (châu Âu): - Thời kỳ hình thành: từ thế kỉ V đến thế kỉ X, hình thành muộn, sau Xã hội phong kiến phương Đông. - Thời kỳ phát triển: từ thế kỷ XI đến XIV, phát triển rất phồn thịnh . - Thời kỳ khủng hoảng: từ thế kỷ XV đến XVI, kết thúc sớm và bắt đầu chuyển sang chủ nghĩa tư bản. - Cơ sở kinh tế: Nông nghiệp đóng kín trong lãnh địa. - Giai cấp cơ bản: Lãnh chúa và nông nô (bóc lột thông qua tô thuế). - Thế chế chính trị: Quân chủ.
tham thảo

Chủ đề: Tinh thần thơ Mới
- Mục đích nghị luận: phản ánh tinh thần thơ Mới, sự cách tân về thơ, từ “cái ta” chuyển sang “cái tôi” đầy màu sắc cá nhân
+ Phần mở đầu: “Bây giờ hãy đi tìm cái điều ta cho là quan trọng hơn: Tinh thần Thơ mới
Phần thân:
- Cái khó trong việc tìm ra tinh thần thơ Mới, xác định cách tiếp cận đúng đắn cần phải có
- Biểu hiện cái “tôi” trong cá nhân Thơ Mới, “cái tôi” buồn, bế tắc nhưng khao khát với cuộc sống, với đất nước, con người
- Tình yêu, lòng say mê với tiếng mẹ đẻ
KB: Nâng cao tinh thần thơ Mới
Thơ mới không đề cập đến đấu tranh cách mạng, trong thơ mới có nỗi buồn của cả một lớp người trong xã hội. Bao trùm thơ mới là nỗi ủy mị. Như nỗi buồn trong nhớ rừng của Thế Lữ, nỗi buồn trong Tràng giang là tình yêu quê hương đất nước.
Nhược điểm của Thơ mới là thiếu khí phách cách mạng, nhưng đây là phong trào thơ với nhiều yếu tố tích cực: lòng yêu quê hương đất nước, yêu con người, yêu sự sống... Tựu chúng lại đều yêu tiếng Việt- biểu hiện tình yêu đất nước.
Thơ Mới đóng góp nhiều về nghệ thuật thơ, đổi mới sự biểu hiện cảm xúc, cảm xúc sâu thẳm về cuộc đời, con người, thiên nhiên, đất nước. Thơ mới trau dồi tiếng Việt làm cho ngôn ngữ thơ Việt Nam uyển chuyển, biến đổi mọi cảm xúc. Có Thơ mới thì không có ngôn ngữ thơ vừa cô đọng, vừa súc tích. Có thể nói Thơ mới là một thời đại dồi dào, sức sáng tạo

- Tóm tắt nội dung cơ bản từng phần:
+ Phần mở đầu (“Việc nhân nghĩa... chứng cớ còn ghi"): Phần đầu nói về tư tưởng nhân nghĩa.
+ Phần 2 (“Vừa rồi... Ai bảo thần nhân chịu được"): Phần hai soi chiếu lí luận vào thực tiễn.
+ Phần 3 (“Ta đây... Cũng là chưa thấy xưa nay"): Phần tiếp theo nói về diễn biến khởi nghĩa Lam Sơn. Hình tượng người anh hùng Lê Lợi là người nông dân áo vải, chọn núi Lam Sơn để dấy nghĩa với lòng căm thù giặc sâu sắc, sục sôi cùng lí tưởng, hoài bão lớn lao và lòng người quyết tâm để thực hiện lí tưởng lớn.
+ Phần kết (“Xã tắc từ đây... Ai nấy đều hay”): Phần cuối cùng sử dụng những hình ảnh về tương lai đất nước nhấn mạnh niềm tin, ý chí: xã tắc từ đây vững bền, Giang sơn từ đây đổi mới.
=> Các phần trong tác phẩm này có mối liên hệ chặt chẽ, logic. Bài Đại cáo viết về vấn đề vạch tội ác của kẻ thù xâm lược, ca ngợi thắng lợi của cuộc khởi nghĩa Lam Sơn.

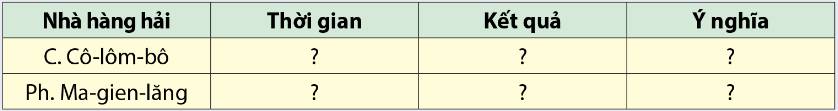
C.Cô-lôm-bô:
- Thời gian: `1492-1502`
- Kết quả: Phát hiện ra vùng đất mới - Châu Mĩ
- Ý nghĩa: Sau cuộc phát kiến địa lý của Cô-lôm-bô, thương nhân châu Âu biết đến châu Mĩ, họ bắt đầu quá trình tiếp xúc, trao đổi kinh tế giữa 2 bên.
Ph. Ma-gien-lăng:
- Thời gian: `1519 - 1522`
- Kết quả: phát hiện ra eo biển nằm ở Cực Nam châu Mĩ (sau này gọi là eo biển Ma-gien-lăng)
- Ý nghĩa: Chứng minh được trái đất có dạng hình cầu.

Nhà lão Hạc là một người nông dân rất nghèo, vợ mất sớm, con trai lão phải đi làm đồn điền cao su để kiếm tiền cưới vợ. Lão ở nhà với chú chó tên là Cậu Vàng và bầu bạn với nó hằng ngày. Lão coi nó là tri kỉ, lão ăn gì nó ăn nấy, tắm rửa cho nó như một đứa con… cùng nhau sống tằng tiện. Nhưng sau một trận ốm nặng, lão không còn đủ sức để nuôi thân nên quyết định bán con chó đi. Lão vô cùng buồn bã và kể chuyện với ông giáo. Vì ân hận đã lừa một con chó, lão ăn bả chó tự tử và nhờ ông giáo trông coi căn nhà, mảnh vườn đợi khi con lão về có nơi làm ăn.