Khi cho SO3 hợp với H2O thu được dung dịch H2SO4
a) Viết phản ứng hóa học
b) Nếu thu được 490kg H2SO4 thì khối luộng của SO3 và H2O là bao nhiêu
biết khối lượng nước trong dung dịch chiếm 90% và cứ 80kg SO3 thì sinh ra 98kg H2SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2SO_4}=\dfrac{200\cdot19.6\%}{98}=0.4\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(0.4......................0.4\)
\(m_{SO_3}=0.4\cdot80=32\left(g\right)\)
\(b.\)
\(n_{H_2SO_4}=\dfrac{80\cdot19.6\%}{98}=0.16\left(mol\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(0.16..........0.16..............0.16\)
\(m_{MgO}=0.16\cdot40=6.4\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.4+80=86.4\left(g\right)\)
\(C\%MgSO_4=\dfrac{0.16\cdot120}{86.4}\cdot100\%=22.22\%\)
a)
$SO_3 + H_2O \to H_2SO_4$
n SO3 = n H2SO4 = 200.19,6%/98 = 0,4(mol)
=> m = 0,4.80 = 32(gam)
b)
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n MgSO4 = n MgO = n H2SO4 = 80.19,6%/98 = 0,16(mol)
=> m MgO = 0,16.40 = 6,4(gam)
Sau pư, m dd = 6,4 + 80 = 86,4(gam)
=> C% MgSO4 = 0,16.120/86,4 .100% = 22,22%

\(n_{SO_3}=\dfrac{200}{80}=2,5\left(mol\right)\)
mdd H2SO4 17% = 1000.1,12 = 1120 (g)
=> \(m_{H_2SO_4}=\dfrac{1120.17}{100}=190,4\left(g\right)\)
PTHH: SO3 + H2O --> H2SO4
2,5------------>2,5
=> mH2SO4(sau pư) = 2,5.98 + 190,4 = 435,4 (g)
mdd sau pư = 200 + 1120 = 1320 (g)
\(C\%_{dd.H_2SO_4.sau.pư}=\dfrac{435,4}{1320}.100\%=32,985\%\)

\(n_{SO_3}=\dfrac{3}{80}=0,0375\left(mol\right)\\ pthh:SO_3+H_2O\rightarrow H_2SO_4\)
b) sản phẩm làm QT hóa đỏ vì sp là axit
\(pthh:SO_3+H_2O\rightarrow H_2SO_4\)
0,0375 0,0375
\(\Rightarrow m_{H_2SO_4}=0,0375.98=3,675\left(g\right)\)
\(C_M=\dfrac{0,0375}{0,25}=0,15M\)

a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g

a) \(n_{SO_3}=\dfrac{m}{M}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: `SO_3 + H_2O -> H_2SO_4`
b) Theo PTHH: `n_{H_2SO_4} = n_{SO_3} = 0,4 (mol)`
`=> m_{H_2SO_4} = 0,4.98 = 39,2 (g)`

a, \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
b, \(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
Theo PT: nNa2SO4 = nH2SO4 = 0,3 (mol) ⇒ mNa2SO4 = 0,3.142 = 42,6 (g)
nNaOH = 2nH2SO4 = 0,6 (mol) ⇒ mNaOH = 0,6.40 = 24 (g)
c, \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,6}{0,4}=1,5\) → Pư tạo NaHCO3 và Na2CO3.
PT: \(2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\)
\(NaOH+CO_2\rightarrow NaHCO_3\)

Câu 5. Cho phương trình hóa học sau SO3 + H2O H2SO4. Chất tham gia phản ứng là
A.SO3, H2SO4. B. H2SO4. C. H2O, H2SO4.
Câu 6. Đốt cháy 12,8 g bột đồng trong không khí, thu được 16g đồng (II) oxit cuo. Khối lượng của oxi tham gia phản ứng là:
A. 32g B. 3,2 g. C. 6,4 g. D. 28,8 g
Bảo toàn khối lượng: \(m_{Cu}+m_{O_2}=m_{CuO}\\ \Rightarrow m_{O_2}=16-12,8=3,2\left(g\right)\)
A nặng gấp 2 lần khí oxi. Khối lượng mol của khí A là:
\(M_A=2M_{O_2}=2.32=64\left(g/mol\right)\)

\(n_{SO_3}=\dfrac{20}{80}=0,25\left(mol\right)\\ PTHH:SO_3+H_2O\rightarrow H_2SO_4\\ Mol:0,25\rightarrow0,25\rightarrow0,25\\ C_{MH_2SO_4}=\dfrac{0,25}{0,5}=0,5M\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ Mol:0,25\leftarrow0,25\\ m_{Mg}=0,25.24=6\left(g\right)\)
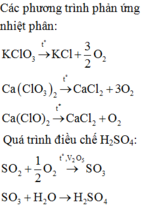
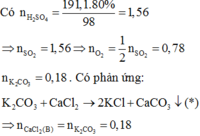


câu b:
Khối lượng dung dịch axit =490kg
Nước chiếm 90% dung dịch => khối lượng nước trong dung dịch=90%*490=441kg
=> khối lượng H2SO4= khối lượng dung dich- khối lượng nước=490-441=49kg
Mà cứ 80kg tạo ra 98 kg H2SO4
=> để tạo ra 49 kg cần dùng 49*80/98=40 kg
=> Khối lượng nước cần dùng để tạo dung dịch axit = m đung djch axit - khối lượng SO3=490-40=450 kg nước
Vậy cần 450 kg nước và 40kg SO3
a) SO3 + H2O -> H2SO4
400 90 490 (kg)
b) Vậy nếu thu được 490 kg H2SO4 thì khối lượng nước là 90 kg còn khối lượng SO3 là 400(kg)