Đốt cháy hoàn toàn 1g bột kim loại m trong oxi dư, thu được chất rắn có khối lượng 1,667g. Xác định m là kim loại nào?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1 :
Gọi X lak tên kim loại đó
Theo đề ra ta có : \(2X+O_2\left(t^o\right)->2XO\)
Ta có : \(n_{XO}=\dfrac{16,2}{M_X+16}\); \(n_X=\dfrac{13}{M_X}\)
Từ PT -> \(n_X=n_{XO}\)
=> \(\dfrac{16,2}{M_X+16}=\dfrac{13}{M_X}\)
Giải phương trình trên ta đc \(M_X=65\left(g/mol\right)\)
-> Kim loại đó lak Zn
Câu 2 :
PTHH : \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(n_{O_2}=\dfrac{V\left(đktc\right)}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Từ PT -> \(n_P=\dfrac{4}{5}n_{O_2}=0,08\left(mol\right)\)
-> \(m_{P\left(PƯđủ\right)}=n.M=0,08.31=2,48\left(g\right)\)

Đáp án B
Chỉ xét kim loại trước H, nếu ko được, chọn Cu
Nhận xét: theo bảo toàn e: 2a + nb = 0,05.2 = 0,1
3a + mb = 0,045.4= 0,18 mol →như vậy m > 3 đoán ra Sn
56 a + 119 b = 4 , 69 a + b = 0 , 05 → a = 0 , 02 b = 0 , 03
%mM= 0,03.119/4,69 = 76,12%

Đặt công thức của oxit thu được là M2Ox ( trong đó x là hóa trị của kim loại)
Do trong oxit oxi chiếm 20% nên kim loại đó sẽ chiếm 80 % về khối lượng => 2M/16x = 80%/20%=4
<=> M = 32x.
Do M là kim loại nên hóa trị của nó là giá trị nguyên chạy trong khoảng 1 đến 3 (lớp 10 có học rồi). Thay lần lượt các giá trị vào x ta sẽ được M=64 và x=2 => M : Cu
Ta có :
2M + O2----> 2MO
2(M+16)
Vì oxi chiếm 20% khối lượng nên ta có:
2(M + 16) . 20% = 32
(2M + 32).20%=32
0,4M + 6.4 =32
0.4M = 32-6.4
0.4M =25.6 ===> M=64 (Cu)
Vậy kim loại đó là Cu

4 A+ 3 O2 -to->2 A2O3
mO2= mA2O3 - mA= 20,4-5,4=15(g)
=>nO2=15/32(mol)
=> nA= 4/3 . 15/32= 5/8(mol)
=>M(A)= mA/nA= 5,4/(5/8)=?? SỐ LẺ EM ƠI

Đáp án B.
Gọi kim loại là R.
Bảo toàn khối lượng:
mO = 16,2 - 13 = 3,2
=> nO2= 0,1 (mol)
2R + O2→ 2RO
0,2 0,1
MR = 65(Zn)

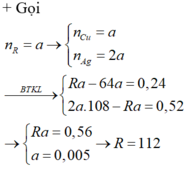
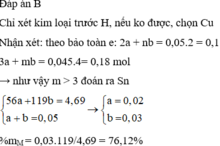
Gọi: kim loại : R ( hóa trị n)
4R + nO2 -to-> 2R2On
4R_____________2(2R + 16n)
1_________________1.667
<=> 1.667R*4 = 4R + 32n
<=> R = 12n
BL :
n= 2 => R = 24
Vậy: R là : Mg