Trong thiên nhiên Br có 2 đồng vị 79Br và 81Br . Biết ngtu khối trung bình của Brom là 79,91 . Phần trăm khối lượng 79Br là ????
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Khối lượng nguyên tử trung bình của Br là
MBr = ( 79 . 54 , 5 + 81 ( 100 - 54 , 5 ) ) / 100 = 79 , 91

Đáp án D
%41K = 100 - 93,26 - 0,012 = 6,728%.
Khối lượng nguyên tử trung bình của K là:
MK = 39 x 0,9326 + 40 x 0,00012 + 41 x 0,06728 = 39,13468.
Khối lượng nguyên tử trung bình của Br là:
MBr = 79,92.
Thành phần phần trăm của 39K trong KBr là
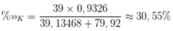

\(a.Đặt:\%^{79}Br=a\left(a>0\right)\\ \Rightarrow \%^{81}Br=100\%-a\\ \overline{NTK}_{Br}=79,91\\ \Leftrightarrow79a+81.\left(100\%-a\right)=79,91\\ \Leftrightarrow a=54,5\%\\ \Rightarrow\%^{79}Br=54,5\%;\%^{81}Br=45,5\%\)
b. Phần trăm theo KL đồng vị 79Br trong phân tử CaBr2:
\(54,5\%.\dfrac{70.91.2}{79,91.2+40}\approx43,59\%\)
c.
\(\left\{{}\begin{matrix}P=E\\P+N=79\\\left(P+E\right)-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P+N=79\\2P-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=35\\N=44\end{matrix}\right.\)

Nguyên tử khối của Brom là :
\(\overline{A}=\frac{79.50,69+81.49,31}{100}\approx79,98u\)
Vậy Nguyên tử khối trung bình của Brom là \(79,98u\)
Nguyên tử khối trung bình của Br là:
\(\overline{A}=\frac{79.50,69+81.49,31}{50,69+49,31}=\frac{7998,62}{100}=79,9862\)
Vậy nguyên tử khối trung bình của Br là 79,9862
Gọi x là % của 79Br => (1 - x) là % của 81Br
Ta có:
79x + 81(1 - x) = 79.91
=> 79x + 81 - 81x = 79.91
=> 2x = 1.09
=> x = 0.545 = 54.5%
Phần trăm khối lượng 79Br là 54.5%
Gọi x là % của 79Br, y là % của 81Br
Ta có: \( \overline{A}\) = \(\frac{79x+81y}{100}=79,91\)
<=> 79x + 81y = 7991 (1)
Mặt khác: x + y = 100 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{{}\begin{matrix}79x+81y=7991\\x+y=100\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}x=54,5\%\\y=45,5\%\end{matrix}\right.\)
Vậy %m79Br = 54,5%