a. Một nguyê tử X có thể tạo thành với Al hợp chất kiểu AlaXb, mỗi phân tử gồm 5 nguyên tử, khối lượng phân tử 150đvC. Xác định X, gọi tên hợp chất AlaXb.
b. Y là một oxit kim loại chứa 70% kim loại ( về khối lượng). Cần dùng bao nhiêu ml dd H2SO4 24,5% (d= 1,2g/ml) để hòa tan vừa đủ 40,0 gam Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

vì nhôm (Al) hóa trị 3 nên hợp chất có dạng :\(Al_aX_3\) gồm 5 nguyên tử \(\Rightarrow a=5-3=2\) \(Al_2X_3\)
\(\Rightarrow\) X có hóa trị 2
\(M=27.2+X.3=150\)
\(\Rightarrow X=32\) => Lưu huỳnh ( S) thõa mãn hóa trị 2.
CTHH của hợp chất \(Al_2S_3\) ( nhóm sulfua ) .
công thức hh dạng: AlaXb mà 1 ptử của nó có 5 ngtử
ta có Al hóa trị 3 nên có tối đa 2 ngtử Al trong AlaXb
theo bài ra ta có: 27.2 + 3.X =150 => X = 32 = S(lưu huỳnh)
cthh là Al2S3

Al luôn hóa trị 3, các NTHH có hóa trị từ 1->7
+ TH1: X(I)=> có 4 nguyên tử (loại)
+TH2:X(II)=> có 5 nguyên tử(chọn)
+TH3:X(III)=>có 2 nguyên tử (loại)
+TH4:X(IV)=>có 7 nguyên tử(loại)
+TH5:X(V)=> có 8 nguyên tử (loại)
+TH6:X(VI)=> có 3 nguyên tử (loại)
+TH7LX(VII)=>có 10 nguyên tử(loại)
=> Al2X3
ta có:
150=2.27+3.X=54+3X
=>X=32=>X là S

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Trả lời
Ta thấy:
a + b = 5
Đặt trường hợp thôi
1. Với a = 1 => b = 4 => Mx = 30.75
2. Với a = 2 => b = 3 => Mx = 32
3. Với a = 3 => b = 2 => Mx = 13.8
4. Với a = 4 => b = 1 => Mx = 42.
Trong 4 trường hợp thì trường hợp 2 có M = 32 là của Lưu huỳnh (S)
=> Hợp chất có công thức Al2S3.

Gọi khối lượng nguyên tử của `X` là `x`
Ta có:
`\text {PTK =} x+32+16*4=120 <am``u>`
`-> x+32+64=120`
`-> x=120 - (32+64)`
`-> x=120-96`
`-> x=24`
Ta có: `x` có khối lượng nguyên tử là `24 am``u`
`->` `X` là nguyên tố \(\text{Magnesium (Mg)}\).

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

Theo đề ta có a+b = 5
Lưu huỳnh có 3 hoá trị II, IV và VI
Nếu S(VI) => a + b > 5 (loại)
Nếu S(IV)
=> công thức hoá học có dạng R4S
Theo cách tính PTK ta có:
4MR + 32 = 150
=> MR = 29,5 (ko có)
Vậy S(II)
=> công thức hoá học có dạng R2S3
Theo cách tính PTK ta có:
2MR + 32.3 = 150
=> MR = 27 (Al)
Vậy công thức hoá học hợp chất là Al2S3

a) CTHH: AxOy
\(\%O=\dfrac{16y}{x.M_A+16y}.100\%=36,78\%\)
=> \(16y=0,3678x.M_A+5,8848y\)
=> \(M_A=\dfrac{27,5y}{x}=13,75.\dfrac{2y}{x}\left(g/mol\right)\)
Có: \(\dfrac{2y}{x}=4\) thỏa mãn
=> MR = 55 (g/mol)
=> R là Mn (Mangan)
\(\dfrac{x}{y}=\dfrac{1}{2}\) => Chọn x = 1; y = 2
CTHH: MnO2
b) PTKX = 55 + 16.2 = 87 (đvC)
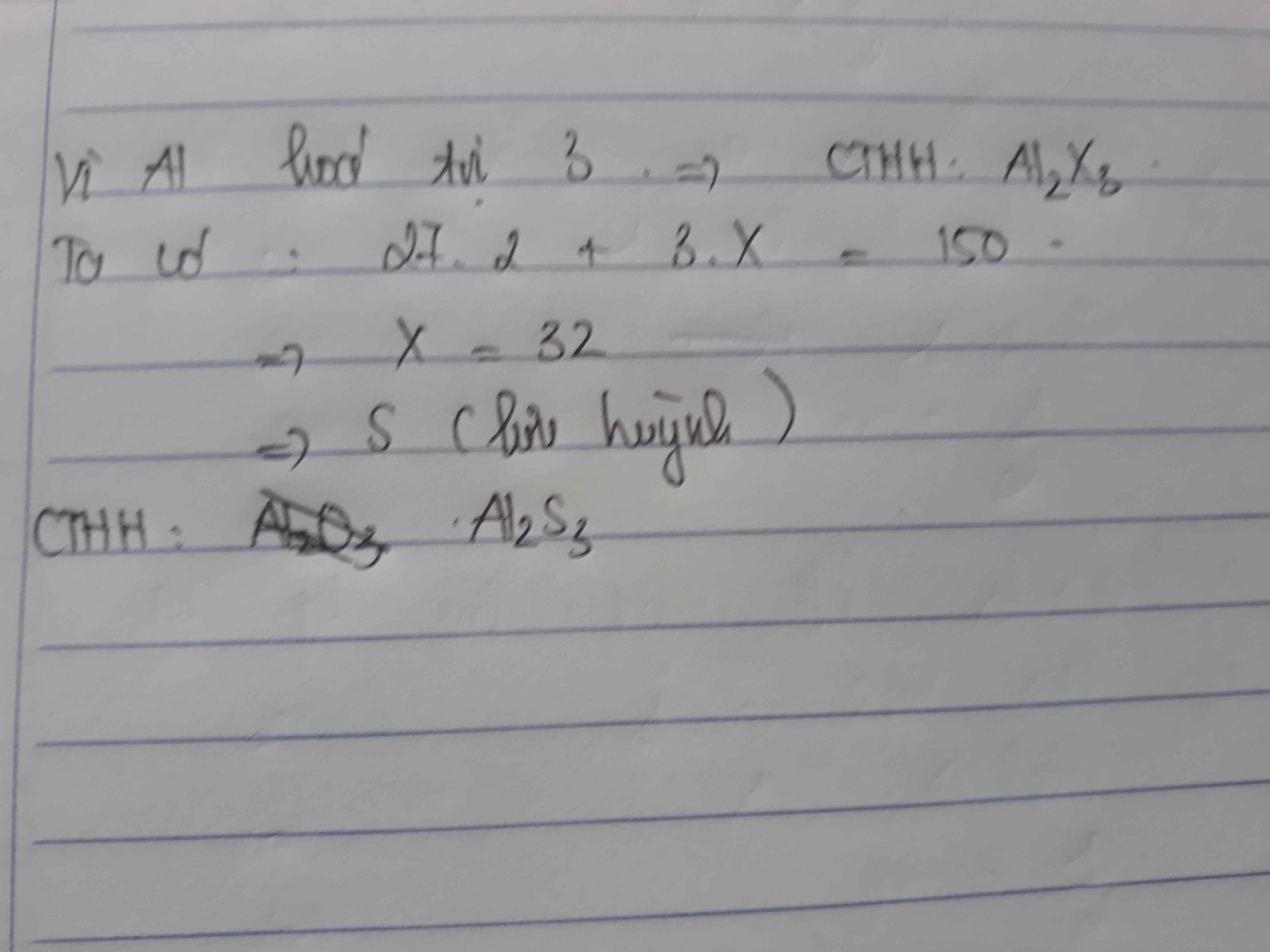
a.
Ta có :
a + b = 5
M = 27a + Xb = 150
<=> 27a + X ( 5-a ) = 150
<=> 27a + 5X - aX = 150
<=> a( 27 - X ) + 5X = 150
BL :
a = 1 => X = 30.75 (l)
a = 2 => X = 32 (n)
a =3 => X = 34.5 (l)
Vì : a = 2 => b = 3
Vậy: CTHH : Al2S3
b . Gọi: CTHH của oxit : R2On
%R = 2R/(2R+16n) *100% = 70%
<=> 2R + 16n = 20R/7
<=> 16n = 6R/7
<=> R = 56n/3
BL :
n = 3 => R = 56
Vậy: CTHH : Fe2O3
nFe2O3 = 0.25 mol
Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
0.25______0.75
mH2SO4 = 73.5 g
mdd H2SO4 = 300 g
Vdd H2SO4 = 250 ml