Tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất sau:
a)SO2
b)Fe2(SO4)3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(M_{Fe_2\left(SO_4\right)_3}=400\left(g\text{/}mol\right)\)
\(\%Fe=\dfrac{56\cdot2}{400}\cdot100\%=28\%\)
\(\%S=\dfrac{32\cdot3}{400}\cdot100\%=24\%\)
\(\%O=100-28-24=48\%\)

a) \(\left\{{}\begin{matrix}\%Fe=\dfrac{56.2}{160}.100\%=70\%\\\%O=100\%-70\%=30\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}\%Al=\dfrac{27.2}{342}.100\%=15,79\%\\\%S=\dfrac{32.3}{342}.100\%=28,07\%\\\%O=\dfrac{16.12}{342}.100\%=56,14\%\end{matrix}\right.\)


\(a,\%H=\dfrac{1}{63}.100\%=1,6\%\\\%N=\dfrac{14}{63}.100\%=22,2\%\\ \%O=100\%-1,6\%-22,2\%=76,2\%\\b,\%Al=\dfrac{54}{342}.100\%=15,8\%\\ \%S=\dfrac{96}{342}.100\%=28,1\%\\ \%O=100\%-15,8\%-28,1\%=56,1\% \%b,b,15,8\%\\ \)

a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
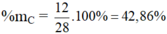
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
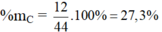
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
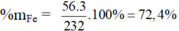
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
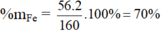
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
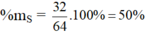
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
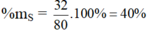
%mO = 100 – 40 = 60%

\(M_{SO_2}=32+16.2=64\left(\dfrac{g}{mol}\right)\\ \Rightarrow\%S=\dfrac{M_S}{M_{SO_2}}=\dfrac{32}{64}=0,5=50\%\)

a/
+ CO
+CO2
b/
+Fe3O4
+ Fe2O3
c/
+SO2
+ SO3

`#3107.101107`
a. Sửa đề: Hãy cho biết khối lượng nguyên tử của mỗi nguyên tố có trong phân tử đó.
- Trong phân tử \(\text{SO}_2\) gồm 2 nguyên tử, nguyên tử S và O
`=>` NTK của S là `32` amu, NTK của phân tử O là `16` amu
b.
Khối lượng phân tử của SO2 là:
\(32+16\cdot2=64\left(\text{amu}\right)\)
c.
Số `%` của S có trong SO2 là:
\(\text{%S }=\dfrac{32\cdot100}{64}=50\left(\%\right)\)
Số `%` của O2 có trong SO2 là:
\(\text{%O = 100%}-\text{50% = 50%}\)
Vậy:
a. S: `32` amu, O: `16` amu
b. PTK của SO2 là `64` amu
c. \(\text{%S = 50%; %O = 50%.}\)
Bài Làm:
a, \(M_{SO_2}=32+16.2=64\) (g/mol)
Trong 1 mol SO2 có 1 mol S và 2 mol O
\(\%m_S=\frac{32}{64}.100\%=50\%\)
\(\%m_O=\frac{16.2}{64}.100\%=50\%\)
Vậy ...
b, \(M_{Fe_2\left(SO_4\right)_3}=56.2+\left(32+16.4\right).3=400\) (g/mol)
Trong 1 mol Fe2(SO4)3 có 2 mol Fe, 3 mol S và 12 mol O.
\(\%m_{Fe}=\frac{56.2}{400}.100\%=24\%\)
\(\%m_S=\frac{32.3}{400}.100\%=24\%\)
\(\%m_O=100\%-24\%-24\%=48\%\)
Vậy ...
Good luck!
a)
MSO2 = 64 g/mol
%S = %O = 32/64*100% = 50%
b)
MFe2(SO4)3 = 400 g/mol
%Fe = 28%
%S = 24%
%O = 48%