Hòa tan 9,4g K2O vaofnuowcs thu được 200g ddA
Khi nhúng quỳ tím vào dd A thì quỳ tím đổi màu nt
C% ddA=?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nM2O=\(\frac{9,4}{2M+16}\) (mol)
- p1 làm quỳ hoá xanh → OH- dư → nOH->nHCl=0,095 (mol)
- p2 làm quỳ hoá đỏ → H+ dư → nHCl>nOH-=0,105 (mol)
\(\Rightarrow0,105\cdot2>\frac{9,4}{2M+16}>0,095\cdot2\)
\(\Leftrightarrow41,474>M>31,14\)
→ M=39 (K) →K2O

nHCl=0,2.0,5=0,1(mol)
nNaOH=0,2.0,3=0,06(mol)
PTHH: NaOH + HCl -> NaCl + H2O
Vì 0,1/1 > 0,06/1
=> NaOH hết, HCl dư
a) Vì HCl dư , NaCl trung tính => dung dịch sau phản ứng làm hóa đỏ quỳ tím.
b) - Dung dịch thu được gồm HCl dư và NaCl.
nHCl(p.ứ)=nNaCl=nNaOH=0,06(mol) -> mNaCl= 0,06.58,5=3,51(g)
nHCl(dư)=0,1-0,06=0,04(mol) -> mHCl(p.ứ)=0,04.36,5=1,46(g)
mddsaup.ứ= mddHCl + mdd NaOH= 200.1,12+300.1,02=530(g)
=> \(C\%ddNaCl=\dfrac{3,51}{530}.100\approx0,662\%\\ C\%ddHCl\left(dư\right)=\dfrac{1,46}{530}.100\approx0,275\%\)
a)
$NaOH + HCl \to NaCl + H_2O$
$n_{HCl} = 0,2.0,5 = 0,1(mol) > n_{NaOH} = 0,3.0,2 = 0,06(mol)$
nên HCl dư
Dung dịch làm quỳ tím hóa đỏ
b)
$m_{dd} = 200.1,12 + 300.1,02 = 510(gam)$
$n_{HCl\ dư} = 0,1 - 0,06 = 0,04(mol)$
$n_{NaCl} = n_{NaOH} = 0,06(mol)$
$C\%_{NaCl} = \dfrac{0,06.58,5}{510}.100\% = 0,69\%$
$C\%_{HCl} = \dfrac{0,04.36,5}{510}.100\% = 0,29\%$

B đúng.
nHBr = 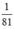 mol
mol
nNaOH = 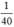 mol
mol
NaOH + HBr → NaBr + H2O
nNaOH > nHBr (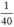 >
> 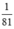 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh

Giấy quỳ tím nhúng vào ......dung dịch bazo.........sẽ làm cho giấy quỳ tím đổi thành màu xanh
Giấy quỳ tím nhúng vào ......dung dịch axit..........sẽ làm cho giấy quỳ tím đổi thành màu đỏ
Giấy quỳ tím nhúng vào bazo sẽ làm cho giấy quỳ tím đổi thành màu xanh
Giấy quỳ tím nhúng vào axit sẽ làm cho giấy quỳ tím đổi thành màu đỏ
nK2O = 9.4/94=0.1 mol
K2O + H2O --> 2KOH
0.1____________0.2
mKOH = 0.2*56=11.2g
Dung dịch sau phản ứng làm quỳ tím hóa xanh
C%KOH = 11.2/200*100% = 5.6%