Đốt cháy 0,528 gam hợp chất X thu được 1,055 gam CO2 và 0,432 gam H2O. Tìm công thức của X. Biết trong phân tử có 4 nguyên tử cacbon.
em cảm ơn mn giúp em1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do sản phẩm sau khi đốt cháy A chứa các nguyên tố C, H, O
=> A chứa C,H và có thể có O
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> nC = 0,15 (mol)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
=> nH = 0,6 (mol)
Xét mC + mH = 0,15.12 + 0,6.1 = 2,4 (g) < 4,8 (g)
=> A chứa C, H, O
\(n_O=\dfrac{4,8-2,4}{16}=0,15\left(mol\right)\)
Xét nC : nH : nO = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
=> CTPT: (CH4O)n
Mà MA < 64 g/mol
=> n = 1
=> CTPT: CH4O

theo định luật bảo toàn khối lương ta có :
mA + mO2 = mCO2 + mH2O
<=> 16 + 64 = mCO2 +H2O
<=> 80 = mCO2 +H2O
đặt 9x là mH2O => mCO2 =11x
ta có : 9x+ 11x= 80
giải tìm x= 4
=>mH2O= 36 g
=>mCO2= 44

Phân huỷ 0,445 gam X thu được 0,0025 mol N2O
→ Phân huỷ 0,356 gam X thu được 0,002 mol N2O
→ Số mol N trong X: 0,004 mol → mN = 0,004.14 = 0,056 gam
nCO2 = 0,012 mol → số mol C trong X: 0,012 mol → mC = 0,144 gam
nH2O = 0,014 mol → số mol H trong X : 0,028 mol → mH = 0,028 gam
mC + mH + mN = 0,228 gam < mX = 0,356 gam
→ Trong X còn có nguyên tử oxi, mO = 0,356 - 0,228 = 0,128 mol
→ Số mol O trong X : 0,008 mol
Đặt CTHH của X là CxHyOzNt
x : y : z : t = nC : nH : nO : nN = 0,012 : 0,028 : 0,008 : 0,004 = 3 : 7 : 2 : 1
Công thức phân tử đơn giản nhất của X là C3H7O2N
Vì X chỉ chứa 1 phân tử N → CTPT trùng với công thức đơn giản nhất
→ CTPT là C3H7O2N

Vì sản phẩm cháy gồm Na2CO3, CO2 và H2O nên trong A chắc chắn có C, H, Na, có thể có O.
Ta có:
![]()
Vì trong A chỉ có một nguyên tử Na => nA = 0,05 mol
![]()
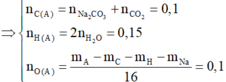
Gọi công thức phân tử của A là C x H y O z Na
Đáp án A.
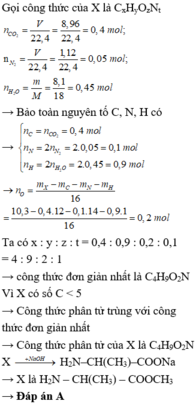


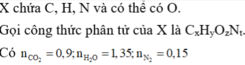

nCO2 = 0,024 mol
nC = 0,024 mol
mC = 0,288 g
nH2O = 0,024 mol
nH = 0,048 mol
mO = 0,528 - 0,288 - 0,048 = 0,192 g
nO = 0,012 mol
Gọi: CTHH là : CxHyOz
x : y : z = 0,024 : 0,048 : 0,012 = 2 : 4 : 1
CTTQ : (C2H4O)n
Vì: phân tử có 4 nguyên tử C
= n=2
Vậy: CTHH : C4H8O2
Cù Văn Thái