Oxi hóa hoàn toàn m gam hỗn hợp X gồm Cu và AI có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Tính giá trị của m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
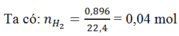
Gọi: nNa = x mol ⇒ nAl = 2x mol
Phản ứng:
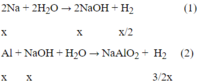
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
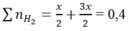
![]()
⇒mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol ⇒ nAl dư = 0,4 - 0,2 = 0,2 mol
⇒mAl = 0,2.27 = 5,4 (g)

Đáp án C
Ta có: nH2= 0,04 mol
Gọi: nNa = x mol " nAl = 2x mol
Phản ứng:
2Na + 2H2O → 2NaOH + H2 (1)
x x x 2
Al + NaOH + H2O → NaAlO2 + 3 2 H2 (2)
x x 3 2 x
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1) ; (2)

⇒ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol ⇒ nAl dư = 0,4 - 0,2 = 0,2 mol
⇒ mAl = 0,2.27 = 5,4 (g)

Đáp án là B
![]()
Bảo toàn khối lượng cho phản ứng cháy : n O 2 = 2 , 225
Bảo toàn O:

BTKL =>m muối = 57,9

Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
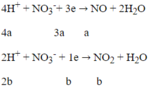
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4

Chọn đáp án D
X : C H 2 = C H - C O O C H 3 , C 2 H 5 O O C - C O O C H = C H 2 , C H 2 = C H - C O O H Y : C 2 H 4 , C H 2 = C H - C H 3
Đốt X, Y quy về đốt anken và CO2:

Thực chất là đốt anken:
![]()
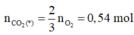
![]()
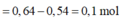
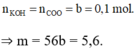
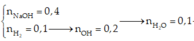


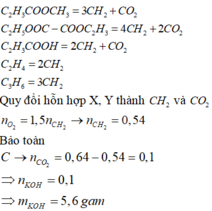
Cu + O2 \(\underrightarrow{to}\) CuO (1)
4Al + 3O2 \(\underrightarrow{to}\) 2Al2O3 (2)
Gọi \(n_{Cu}=n_{Al}=x\left(mol\right)\)
Theo pT1: \(n_{CuO}=n_{Cu}=x\left(mol\right)\)
\(\Rightarrow m_{CuO}=80x\left(g\right)\)
Theo Pt2: \(n_{Al_2O_3}=\frac{1}{2}n_{Al}=0,5x\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,5x\times102=51x\left(g\right)\)
Ta có: \(m_{CuO}+m_{Al_2O_3}=13,1\)
\(\Leftrightarrow80x+51x=13,1\)
\(\Leftrightarrow131x=13,1\)
\(\Leftrightarrow x=0,1\)
Vậy \(n_{Cu}=n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,1\times64=6,4\left(g\right)\)
\(\Rightarrow m_{Al}=0,1\times27=2,7\left(g\right)\)
Vậy \(m=m_{Cu}+m_{Al}=6,4+2,7=9,1\left(g\right)\)
Đặt :
nCu = nAl= x mol
Cu + 1/2O2 -to-> CuO
x______________x
2Al + 3/2O2 -to-> Al2O3
x_______________0.5x
mY = 80x + 0.5x* 102 = 13.1
=> x = 0.1
mhh= m = 0.1*64 + 0.1*27 = 9.1g