Hòa tan 1.35 gam 1 kim loại R bằng dung dịch HNO3 loãng dư thu được 2.24 lít hỗn hợp khí X gồm NO và NO2. Xác định tên của R, biết tỉ khối của X so với H2 bằng 21
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol của Cu là a => nAl= 2a, nMg= 3a
mCu+mAl+mMg = 19 => a=0,1 =>nCu=0,1(mol);nAl=0,2(mol);nMg=0,3(mol)
dY/H2 =18,5 => M(Y)= 37 (dùng pp đường chéo) => nNO=nN2O
n(Y)= \(\dfrac{4,48}{22,4}\) =0,2 (mol)
Suy ra: nNO=nN2O= 0,1 (mol)
nNH4NO3 =\(\dfrac{\text{0,1.2+0,2.3+0,3.2−0,1.3−0,1.8 }}{8}\)=0,0375 (mol) bảo toàn e nhe
mm′ = mCu(NO3)2+ mAl(NO3)3 +mMg(NO3)2+mNH4NO3 = 108,8(g) ( khúc này bảo toàn nguyên tố Cu,Al,Mg => số mol của muối Cu2+,Al3+,Mg2+ )

Đáp án B
Tính số mol các khí trong B:
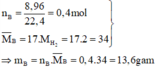
Đặt số mol các khí trong B là NO : a mol ; NO2 : b mol
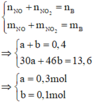
Số mol của M là: n M = 32 M m o l
Gọi n là hóa trị của M
Sơ đồ phản ứng:


Đáp án D
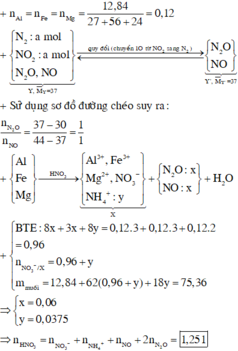
Có : nFe = nAl = nMg = 0,12 mol
Y : N2 ; N2O ; NO và NO2( N2 và NO2 có số mol bằng nhau)
=> Qui đổi : NO2 +N2 -> NO + N2O
=> Y trở thành : NO và N2O với số mol lần lượt là x và y.
Có : MY = 37g => mY = 37(x + y) = 30x + 44y
=> x = y(1)
Giả sử có z mol NH4NO3 trong muối
Bảo toàn e : 3nFe + 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3
=> 3x + 8y + 8z = 0,96 mol(2)
Và : nHNO3 = (4x + 10y + 10z)
=> nH2O = ½ (nHNO3 – 4nNH4NO3) = (2x + 5y + 3z) mol
Bảo toàn khối lượng :
mY = mKL + mHNO3 – mH2O - mmuối X = (216x + 540y + 576z) – 62,52 = 37(x + y)
=> 179x + 503y + 576z = 62,52(3)
Từ (1),(2),(3) => x = y = 0,06 ; z = 0,0375 mol
=> nHNO3 pứ = 4x + 10y + 10z = 1,215 mol

\(Đặt:n_A=x\left(mol\right),n_{NO}=a\left(mol\right),n_{NO_2}=b\left(mol\right)\)
\(Giảsử:n_{khí}=1\left(mol\right)\)
\(\Rightarrow a+b=1\left(mol\right)\left(1\right)\)
\(\overline{M_{khí}}=\dfrac{30a+46b}{a+b}=20\cdot2\)
\(\Leftrightarrow30a+46b=40\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.375,b=0.625\)
\(BTe:2n_A=3n_{NO}+n_{NO_2}\Rightarrow n_A=\dfrac{3\cdot0.375+0.625}{2}=0.875\left(mol\right)\)
\(m_{A\left(NO_3\right)_2}=0.875\cdot\left(A+124\right)=66.15\left(g\right)\\ \Rightarrow A=\)
Đến đây bạn xem lại đề nhé.

Đáp án : A
.nFe = nAl = nMg = 0,24 mol
Vì HNO3 dư nên tạo muối Fe3+. Nếu có NH4NO3 thì :
=> nNH4NO3 = 0,075 mol
Vì N2 và NO2 có số mol bằng nhau => qui về NO và N2O
Bảo toàn e : 8nNH4NO3 + 3nNO + 8nN2O = 3nAl + 3nFe + 2nMg
=> 3nNO + 8nN2O = 1,32 mol
Mtb (NO,N2O) = 37g
=> nNO = nN2O = 0,12 mol
=> nHNO3 pứ = 10nNH4NO3 + 4nNO + 10nN2O = 2,43 mol

Có : nFe = nAl = nMg = 0,12 mol
Y : N2 ; N2O ; NO và NO2( N2 và NO2 có số mol bằng nhau)
=> Qui đổi : NO2 +N2 -> NO + N2O
=> Y trở thành : NO và N2O với số mol lần lượt là x và y.
Có : MY = 37g => mY = 37(x + y) = 30x + 44y
=> x = y(1)
Giả sử có z mol NH4NO3 trong muối
Bảo toàn e : 3nFe + 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3
=> 3x + 8y + 8z = 0,96 mol(2)
Và : nHNO3 = (4x + 10y + 10z)
=> nH2O = ½ (nHNO3 – 4nNH4NO3) = (2x + 5y + 3z) mol
Bảo toàn khối lượng :
mY = mKL + mHNO3 – mH2O - mmuối X = (216x + 540y + 576z) – 62,52 = 37(x + y)
=> 179x + 503y + 576z = 62,52(3)
Từ (1),(2),(3) => x = y = 0,06 ; z = 0,0375 mol
=> nHNO3 pứ = 4x + 10y + 10z = 1,215 mol
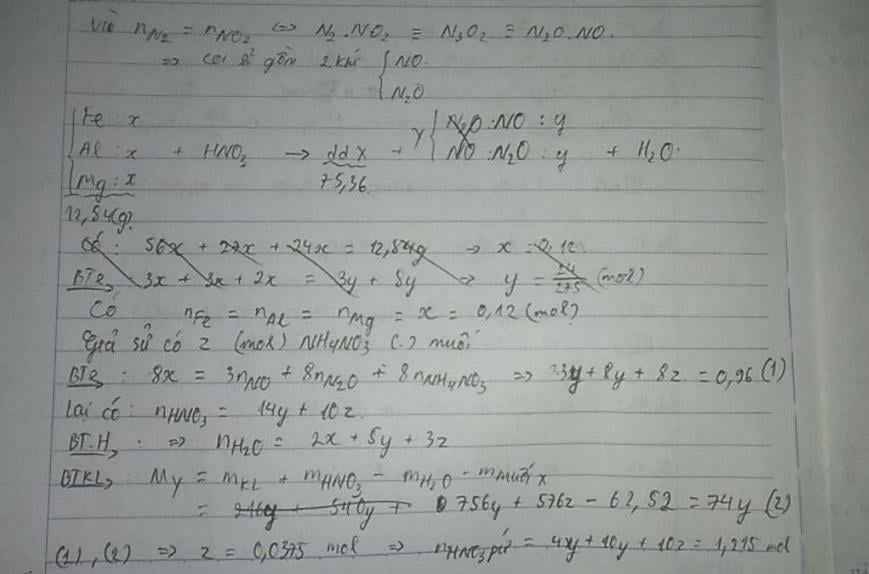
Thanks bạn cực nhiều nek