Cho hỗn hợp rắn A gồm KCl và KBr tác dụng với dung dịch AgNO3 dư. Lượng kết tủa sinh ra sau khi làm khô có khối lượng bằng lượng AgNO3 đã phản ứng. Xác định % khối lượng mỗi muối trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


NaCl + AgNO3 => AgCl + NaNO3
KBr + AgNO3 => AgBr + KNO3
Gọi x,y (mol) lần lượt là số mol của NaCl và KBr
Theo đề bài và phương trình ta có:
58.5x + 119y = 3.55
143.5x + 188y = 6.63
Giải hpt trên, ta được: x = y = 0.02
mNaCl = n.M = 0.02x58.5 = 1.17 (g)
mKBr = n.M = 0.02x119 = 2.38 (g)

Trường hợp 1:
Cả 2 muối cùng phản ứng
Gọi số mol
AgCl : x mol ; AgBr: y mol
\(\left\{{}\begin{matrix}74,5x+119y=87,4\\143,5x+188y=33,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-4,07\\y=3,28\end{matrix}\right.\)
Có nghiệm âm, loại
Trường hợp 2
Chỉ có KCl tác dụng
\(n_{AgCl}=\frac{33,15}{143,5}=0,23\left(mol\right)\)
\(n_{AgCl}=n_{KCl}=0,23\left(mol\right)\)
\(m_{KCl}=0,23.74,5=17,135\left(g\right)\)
\(m_{KBr}=87,4-17,35=70,265\left(g\right)\)
Trường hợp 3:
Chỉ có KBr tác dụng:
\(n_{AgBr}=\frac{33,15}{188}=0,18\left(mol\right)\)
\(n_{AgBr}=n_{KBr}=0,18\left(mol\right)\)
\(m_{KBr}=0,18.119=21,42\left(g\right)\)
\(m_{KCl}=87,4-21,42=65,98\left(g\right)\)

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

chọn mAgNO3=100g
Gọi : nNaCl =xmol
nNaBr =ymol
x+y=100/170
143.5x+188y=100
=>x=360/1513 mol
y=530/1513mol
=>mNACl=360*68.5/ 1513 =13.92g
mNaBr=530*103/1513=36.08g
=>%NaCl=13.92*100(13.92+36.08)=27.8%
=> % NaBr =100-27,8=72,2%
cho e hỏi là níu mình chọn mAGNO3=100g thì đó là phần KL đủ đã tham gia phản ứng hay phần KL ban đầu (là phần Kl dư) v ?
+níu là phần đủ thì phần kết tủa sẽ bằng với mAgNO3 nhưng còn phần dư mà đề nói,,,là bnhiu?
+níu là phần KL ban đầu v thì KL phần kết tủa sẽ k bằng 100 đc ? giải thích hộ e vs, e hioe thắt mắt ![]()

Đáp án A
Bài này có thể giải theo kinh nghiệm,
hoặc biện luận rào số mol hỗn hợp A.
Từ đó ⇒ giới hạn của chất rắn C
Trường hợp xả ra đó là:
Fe pứ hết và Cu chỉ pứ 1 phần
⇒ C gồm Ag và Cu chưa tan.
+ Sơ đồ ta có:
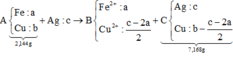

PT theo khối lượng oxit:
40c = 2,56 Û c = 0,064 mol
⇒ CM AgNO3 = 0,064 ÷ 0,2 = 0,32

Bài này có thể giải theo kinh nghiệm, hoặc biện luận rào số mol hỗn hợp A.
Từ đó ⇒ giới hạn của chất rắn C
Trường hợp xả ra đó là:
Fe pứ hết và Cu chỉ pứ 1 phần ⇒ C gồm Ag và Cu chưa tan.
+ Sơ đồ ta có:
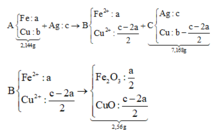
PT theo khối lượng oxit: 40c = 2,56 Û c = 0,064 mol
⇒ CM AgNO3 = 0,064 ÷ 0,2 = 0,32
Đáp án A



