Hỗn hợp X gồm hai axit hữu cơ có công thức tổng quát CnH2n+1COOH với n ≥≥ 0. Cho 13,4 gam hỗn hợp X tác dụng với dung dịch NaOH 1M thì vừa hết V ml. Cô cạn dung dịch sau phản ứng thu được 17,8 gam hỗn hợp muối khan.
- Xác định công thức phân tử của hai axit. Biết số mol của chúng trong hỗn hợp bằng nhau.
- Tính V và thành phần % khối lượng của mỗi axit trong hỗn hợp.

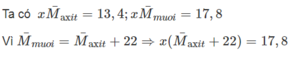
CnH2n+1COOH + NaOH => (to) CnH2n+1COONa + H2O
Đặt CT chung của 2 axit là CnH2n+1COOH
Theo đề bài và phương trình, ta có:
\(\frac{13.4}{12n+2n+1+12+16.2+1}=\frac{17.8}{12n+2n+1+12+16.2+23}\)
Giải phương trình ta được
n = 1.5
Vậy 2 axit có công thức
CH3COOH và C2H5COOH
CH3COOH + NaOH => (to) CH3COONa + H2O
C2H5COOH + NaOH => (to) CH3COONa + C2H5OH
Ta có: nCH3COOH = nC2H5COOH
Gọi x là mol CH3COOH
60x + 74x = 13.4 => x = 0.1 (mol)
nNaOH = 0.1x2=0.2 (mol)
V = 0.2/1 = 0.2 l = 200 ml
mCH3COOH = n.M = 60x0.1 = 6 (g)
mC2H5COOH = n.M = 74x0.1 = 7.4(g)
%mCH3COOH = 44.78% => %mC2H5COOH = 55.22%