Trong công nghiệp luyện kim dùng khí H2 để khử các oxit sắt Fe3O4,Fe2O3,FeO. Nếu tốn cùng 1 lượng H2 thì trường hợp nào thu được nhiều sắt nhất?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: Fe + 2HCl -> FeCl2 + H2
Mol: 0,2 <--- 0,4
Đặt nFe2O3 = a (mol); nFeO = b (mol)
160a + 72b = 15,2 (1)
PTHH: Fe2O3 + 3H2 -> (to) 2Fe + 3H2O
Mol: a ---> 3a ---> 2a
FeO + H2 -> (to) Fe + H2O
Mol: b ---> b ---> b
2a + b = 0,2 (2)
(1)(2) => a = 0,05 (mol); b = 0,1 (mol)
mFe2O3 = 0,05 . 160 = 8 (g)
%mFe2O3 = 8/15,2 = 52,63%
%mFeO = 100% - 52,63% = 47,37%
nH2 = 0,05 . 3 + 0,1 = 0,25 (mol)
VH2 = 0,25 . 22,4 = 5,6 (l)

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
a+b) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,2\left(mol\right)\\n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,2\cdot160=32\left(g\right)\\V_{H_2}=0,6\cdot22,4=13,44\left(l\right)\end{matrix}\right.\)
c) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Zn}=n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,6\cdot65=39\left(g\right)\)
a,
nFe = 22,4/56 = 0,4 (mol)
PTHH
Fe2O3 + 3H2 ---to----) 2Fe + 3H2O (1)
theo phương trình (1) ,ta có:
nFe2O3 = 0,4 x 2 / 1 = 0,8 (mol)
mFe2O3 = 160 x 0,8 = 128 (g)
b,
theo pt (1)
nH2 = (0,4 x 3)/2 = 0,6 (mol)
=) VH2 = 0,6 x 22,4 = 13,44 (L)
c,
PTHH
Zn + H2SO4 -------------) ZnSO4 + H2 (2)
Số mol H2 cần dùng là 0,6 (mol)
Theo PT (2) :
nZn = nH2 ==) nZn = 0,6 x 65 = 39 (g)

Ta có :
\(\dfrac{m_{FeO}}{m_{Fe_2O_3}}=\dfrac{9}{20}\Rightarrow\dfrac{72n_{FeO}}{160n_{Fe_2O_3}}=\dfrac{9}{20}\Rightarrow\dfrac{n_{FeO}}{n_{Fe_2O_3}}=\dfrac{9}{20}:\dfrac{72}{160}=1\)
Do đó, ta coi X chỉ gồm $Fe_3O_4$
$n_{Fe} = \dfrac{29,4}{56}= 0,525(mol)$
\(Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\)
0,175 0,7 0,525 (mol)
$V = (0,7 : 80\%).22,4 = 19,6(lít)$
$m = (0,175 :80\%).232 = 50,75(gam)$

a) Số mol của khí H2 là:
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(PTHH:Fe_3O_4+4H_2\xrightarrow[]{t^0}3Fe+4H_2O\)
tỉ lệ :1 4 3 4
số mol :0,15 0,6 0,45 0,6
Khối lượng kim loại Fe thu được là:
\(m_{Fe}=n_{Fe}.M_{Fe}=0,45.56=25,2\left(g\right)\)
b) Khối lượng oxi sắt từ cần dùng là:
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,15.232=34,8\left(g\right)\)

Chọn đáp án D
Cách 1:
![]()
⇒ Chọn D
Cách 2: Bảo toàn khối lượng khi đã biết nCO = nCO2 = 0,325 theo bảo toàn nguyên tố. Ta có sơ đồ
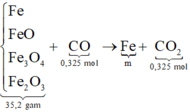
![]()
⇒ Chọn D

a, \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe_3O_4}=\dfrac{1}{15}.232=\dfrac{232}{15}\left(g\right)\)
c, \(n_{H_2}=\dfrac{4}{3}n_{Fe}=\dfrac{4}{15}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{4}{15}.22,4=\dfrac{448}{75}\left(l\right)\)
d, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=n_{H_2}=\dfrac{4}{15}\left(mol\right)\Rightarrow m_{Zn}=\dfrac{4}{15}.65=\dfrac{52}{3}\left(g\right)\)
\(n_{HCl}=2n_{H_2}=\dfrac{8}{15}\left(mol\right)\Rightarrow m_{HCl}=\dfrac{8}{15}.36,5=\dfrac{292}{15}\left(g\right)\)

B1 :
4CO + Fe3O4-----.3Fe + CO2
0,8 0,2mol <---0,6mol
mFe3O4 = 0,2*232=46,4 gam
Vco2 = 0,8 *22,4= 17.92 lít
