Phân tử 1 hợp chất gồm nguyên tử X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O. Tính NTK, ho bt tên và kí hiệu của nguyên tử đó.Tính phần trăm về khối lượng nguyên tử của nguyên tố X trong hợp chất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức hóa học A : XH4
Vì phân tử chất đó nặng gấp 8 lần phân tử Hiđrô nên :
\(\frac{M_A}{2.M_H}=8\)
\(\frac{M_A}{2.1}=8\)
\(\rightarrow M_A=16\)
Mặt khác :
\(M_A=M_X+4.M_H\)
\(\rightarrow M_X+4=16\)
\(M_X=12\)
\(\rightarrow X\) là Cacbon, ký hiệu là C, nguyên tử khối là 12 đvC.
\(\%X=\frac{M_X}{M_A}.100\%=\frac{12}{16}.100\%=75\%\)
Vậy ...
Ta có :
PTKH = 1 * 2 = 2 đvC
=> PTKhợp chất = 2 * 8 = 16 đvC
do hợp chất gồm nguyên tử nguyên tố X và 4 nguyên tử Hiđro
=> PTKhợp chất = NTKX + NTKH * 4
=> 16 đvC = NTKX + 4 đvC
=> NTKX = 12 đvC
=> X là nguyên tố Cacbon (C)
=> % của X trong hợp chất trên là :
12 : 16 * 100% = 75%

\(a,PTK_{HC}=NTK_{O}=16(đvC)\\ b,PTK_{HC}=NTK_{X}+4NTK_{H}=16(đvC)\\ \Rightarrow NTK_{X}=16-4=12(đvC)\\ \text {Vậy x là Cacbon (C)}\\ c,CTHH_{HC}:CH_4\)

Phân tử gồm 1X và 4H
Phân tử khối của hợp chất trên: X + 4 = 16.
Nguyên tử khối của X = 16 – 4 = 12đvC.
Vậy X là nguyên tố cacbon: C

Hợp chất tạo nên bởi 1 nguyên tử nguyên tố Y liên kết với 2 nguyên tử O.
Do vậy hợp chất có dạng: YO2YO2
MYO2=Y+16.2=Y+32MYO2=Y+16.2=Y+32
→%mO=16.2Y+32=50%→Y=32(u)→%mO=16.2Y+32=50%→Y=32(u)
Vậy Y là S (lưu huỳnh).
Suy ra :
MSO2=32+16.2=64(u)=MCuMSO2=32+16.2=64(u)=MCu
Phân tử chất này nặng bằng nguyên tử Cu.
Ta có :
NTK2O = 16 * 2 = 32 (đvC)
=> NGUYÊN TỬ KHỐI của hợp chất trên là :
32 : 50% = 64 (đvC)
Do trong hợp chất trên gồm nguyên tử Y liên kết với 2 nguyên tử Oxi
=> NTKhợp chất = NTKY + NTK2O
=> 64 đvC = NTKY + 32 đvC
=> NTKY = 32 đvC
=> Y là nguyên tố Lưu huỳnh ( S )

a)* XH2=34
= X+2=34
=X=34-2=32
=>X lá S (lưu huỳnh)
*Y2O=44
= 2Y+ 16=44
=2Y= 44-16=28
=> Y= 14 => Y là N ( nitơ)

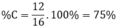
a) Ta có: XH4 = 16
=> X + 4 = 16
<=> X = 12
Vậy X là Cacbon (C)
b) %m(CH4) = 12/16.100% = 75%
Mình làm xong lâu r bạn ơi