Dùng 150 gam quặng pirit chứa 20% chất trơ điều chế H2SO4 . Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m gam Fe2O3 . Tât cả PƯ xảy ra hoàn toàn . Hãy : a) Tính khối lượng H2SO4 điều chế được ? b) Tính m?
giúp mk với các tình yêu nha.❤
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

vì trong quặng pirit chứa 20% chất trơ nên FeS2 chiếm 80% trong quặng pirit nên ta có:
m FeS2 = \(\dfrac{150\cdot80}{100}=120\left(g\right)\)
PTHH
4FeS2 + 11O2 -to-> 2Fe2O3 + 8SO2
2SO2 + O2 -to- V2O5 -> 2SO3
SO3 + H2O -> H2SO4
Từ ba phương trình hóa học trên ta có chuỗi phản ứng:
FeS2 -> 2 SO2 -> 2 SO2 -> 2 H2SO4
1mol ->2 mol ->2 mol ->2mol
120g------------------------>196g
120g------------------------->196g
vậy điều chế được 196 g H2SO4
n H2SO4 = \(\dfrac{m}{M}=\dfrac{196}{98}=2\left(mol\right)\)
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
1 mol---3mol---------1mol-----------3mol
2/3 mol <-2mol
mFe2O3 = n*M = \(\dfrac{2}{3}\cdot160\approx106,7\left(g\right)\)

\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)

Đáp án A.
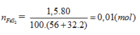
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
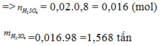

m(FeS2)=(100%-20%).1=0,8(tấn)
4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
\(mSO2\left(LT\right)=\dfrac{0,8.512}{480}=\dfrac{64}{75}\left(tấn\right)\\ \rightarrow mSO2\left(TT\right)=\dfrac{64}{75}.90\%=\dfrac{96}{125}\left(tấn\right)\)
SO2 + 1/2 O2 \(⇌\) SO3
\(mSO3\left(LT\right)=\dfrac{\dfrac{96}{125}.80}{64}=\dfrac{24}{25}\left(tấn\right)\\ mSO3\left(TT\right)=\dfrac{24}{25}.64\%=\dfrac{384}{625}\left(tấn\right)\)
SO3+ H2O -> H2SO4
\(mH2SO4\left(LT\right)=\dfrac{\dfrac{384}{625}.98}{80}=\dfrac{2352}{3125}\left(tấn\right)\\ mH2SO4\left(TT\right)=\dfrac{2352}{3125}.80\%=\dfrac{9408}{15625}\left(tấn\right)\)
=> \(mddH2SO4\left(72\%\right)=\dfrac{\dfrac{9408}{15625}.100}{72}=0,836\left(tấn\right)\)
m(FeS2)=(100%-20%).1=0,8(tấn)
4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
mSO2(LT)=0,8.512480=6475(tấn)→mSO2(TT)=6475.90%=96125(tấn)���2(��)=0,8.512480=6475(�ấ�)→���2(��)=6475.90%=96125(�ấ�)
SO2 + 1/2 O2 ⇌⇌ SO3
mSO3(LT)=96125.8064=2425(tấn)mSO3(TT)=2425.64%=384625(tấn)���3(��)=96125.8064=2425(�ấ�)���3(��)=2425.64%=384625(�ấ�)
SO3+ H2O -> H2SO4
mH2SO4(LT)=384625.9880=23523125(tấn)mH2SO4(TT)=23523125.80%=940815625(tấn)��2��4(��)=384625.9880=23523125(�ấ�)��2��4(��)=23523125.80%=940815625(�ấ�)
=> mddH2SO4(72%)=940815625.10072=0,836(tấn)

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)