Cho 20,2 gam hỗn hợp gồm Zn và Mg tác dụng vừa đủ với S. Sau khi phản ứng hoàn toàn thấy thu được 36,2 gam hỗn hợp các muối sunfua. Tính phần trăm khối lượng của Zn trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2SO_4}=0,5.1=0,5\left(mol\right)\)
PTHH:
Zn + H2SO4 ---> ZnSO4 + H2
a---->a
Mg + H2SO4 ---> MgSO4 + H2
b------>b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}65a+24b=20,2\\a+b=0,5\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\\ \rightarrow m_{Zn}=0,2.65=13\left(g\right)\\ \rightarrow\%m_{Zn}=\dfrac{13}{20,2}.100\%=64,36\%\)

Đáp án A
Gọi nZn = a; nFe = b thì nCu = a + b
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65a + 56b = 64(a+b) ⇔ a = 8b
Vậy phần trăm khối lượng cúa Zn trong hỗn hợp ban đầu là:
% m Z n = 65 . 8 b 65 . 8 b + 56 b . 100 % = 90 , 27 %

CuSO4 → KL pư hết.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) ⇒ m = 65a + 56b (1)
BT e, có: 2a + 2b = 2nCu ⇒ nCu = a + b (mol) ⇒ m = 64(a + b) (2)
Từ (1) và (2) ⇒ 65a + 56b = 64a + 64b
⇒ a = 8b
\(\Rightarrow\%m_{Zn}=\dfrac{65a}{65a+56b}.100\%=\dfrac{65.8b}{65.8b+56b}.100\%\approx90,28\%\)

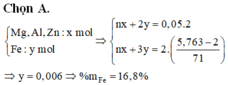
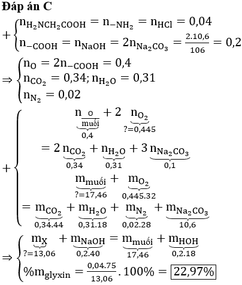

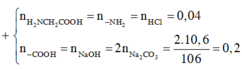
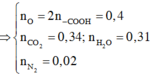

đây bài về rồi!!!! chép đi nha.Ráng nhìn nha tại nhà tui cúp nước nên chụp hơi mờ.!!