Đốt 6,7 gam hỗn hợp X gồm các kim loại Fe, Al, Cu và Ag trong không khí. Sau phản ứng thu được 8,7 gam hỗn hợp chất rắn Y. Hoà tan Y bằng dung dịch HCl dư thấy còn lại 2,7 gam một chất rắn.
a) Viết các phương trình hoá học.
b) Tính thể tích dung dịch HCl 2M vừa đủ để hoà tan Y.

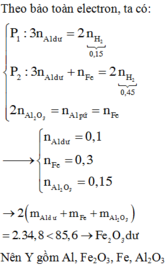




Ag không tác dụng với oxi và HCl => 2,7g chất rắn không tan là Ag.
PTHH: Hỗn hợp X với oxi:
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
PTHH: Hỗn hợp chất rắn Y với HCl:
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
So sánh các phản ứng của hỗn hợp X với oxi và hỗn hợp Y với HCl, ta thấy:
\(n_{HCl}=2n_{\left(trongoxit\right)}\)
\(m_{O_2}=8,7-6,7=2\left(g\right)\)
\(n_{O\left(trongoxit\right)}=0,125\left(mol\right)\)
\(\Rightarrow n_{HCl}=0,125.2=0,25\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,25}{2}=0,125\left(l\right)\)