Hấp thụ hoàn toàn 4,48 l khí CO2 (đktc) vào 500 ml dd hỗn hợp gồm NaOH 0,1 M và Ba(OH)2 0,2 M sinh ra m g kết tủa . Tính m ?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

9 tháng 7 2019
Chọn A
nCO32- = nOH- - nCO2 = 0,25 – 0,2 = 0,05 mà nBa2+ = 0,1 ⇒ mBaCO3↓ = 0,05.197 = 9,85g

13 tháng 12 2018
Đáp án A
nCO32- = nOH- - nCO2 = 0,25 – 0,2 = 0,05 mà nBa2+ = 0,1=> mBaCO3↓ = 0,05.197 = 9,85g Chọn A.

26 tháng 4 2019
Đáp án : A
nCO2 = 0,2 mol ; nOH = 2nBa(OH)2 + nNaOH = 0,25 mol
=> nCO3 = nOH – nCO2 = 0,25 – 0,2 = 0,05 mol < Ba2+ = 0,1 mol
=> m = mBaCO3 = 9,85g

23 tháng 2 2019
Chọn đáp án C
+ Lúc đầu, 0,1 mol CO2 chuyển Ba(OH)2 thành BaCO3.
+ Sau đó, 0,05 mol CO2 chuyển NaOH thành NaHCO3.
+ Còn lại 0,05 mol CO2 hòa tan 0,05 mol kết tủa, như vậy còn lại 0,05 mol BaCO3

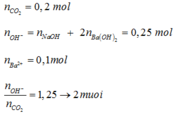
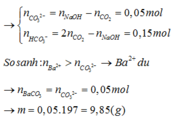
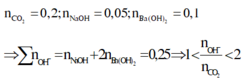

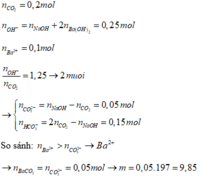
nCO2 = 0,2 mol
nNaOH = 0,05 mol
nBa(OH)2 = 0,1 mol
PT
Ba(OH)2 + CO2 = BaCO3 + H2O
0,1...............0,1..........0,1
2NaOH + CO2 = Na2CO3 + H2O
0,05...........0,025....0,025
Na2CO3 + CO2 + H2O = NaHCO3
0,025............0,025
BaCO3 + H2O + CO2 = Ba(HCO3)2
....0,05.........(0,2-0,1-0,025-0,025)
=> nBaCO3(kh tan) = 0,1 - 0,05 =0,05 (mol)
mBaCO3 = 0,05 . 197 = 9,85 g