Hòa tan hết một lượng Ma vào dung dịch HCl 10% , thu được 46,88 gam dung dịch gồm NaCl và NaOH và 1,568 lít khí H2(đktc).
Nồng độ % của Nacl trong dung dịch là bn ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
8,72 X C r : x m o l C r O : y m o l C r 2 O 3 : z m o l → H 2 S O 4 0 , 07 m o l H 2 + Y C r S O 4 : x + y C r ( S O 4 ) 3 : ≈ → d u N a O H ( y + x ) m o l C r ( O H ) 2 + Z N a [ C r ( O H ) 4 ] N a O H N a 2 S O 4 : x + y + 3 ≈ → + B a C l 2 + C l 2 B a C r O 4 : 2 B a S O 4 : x + y + 3
Gọi số mol của Cr, CrO, Cr2O3 lần lượt là x, y, z mol
Khi tác dụng với H2SO4 chỉ có Cr tác dụng sinh ra khí H2
Bảo toàn electron → x = nH2 = 0,07 mol
Có nCr(OH)2 = x+ y = 8,6 : 86 = 0,1 → y = 0,03 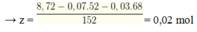
m↓ = 0,04. 253 + ( 0,07 + 0,03 + 3. 002) . 233= 47,4 gam.

+ Tính được những gì có thể tính được
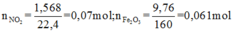
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
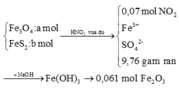
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a_____a (mol)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b_____3b_______b_____\(\dfrac{3}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27b=36,1\\a+\dfrac{3}{2}b=\dfrac{21,28}{22,4}=0,95\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,5\\b=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,5\cdot56=28\left(g\right)\\m_{Al}=8,1\left(g\right)\end{matrix}\right.\)
b+c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{HCl}=2a+3b=1,9\left(mol\right)\\n_{FeCl_2}=0,5\left(mol\right)\\n_{AlCl_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{HCl}}=\dfrac{1,9}{0,2}=9,5\left(M\right)\\C_{M_{FeCl_2}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)