Có 4 lọ mất nhãn đựng bốn loại bột \(Na_2O,P_2O_5,CaO,Fe_2O_3\). Hãy trình bày cách nhận biết 4 lọ. Viết PTHH.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa đỏ là $HCl$
- mẫu thử nào làm quỳ tím hóa xanh là $NaOH$
Cho dung dịch $BaCl_2$ vào hai mẫu thử còn
- mẫu thử tạo kết tủa trắng là $Na_2SO_4$
$Na_2SO_4 + BaCl_2 \to BaSO_4 + 2NaCl$
- mẫu thử không hiện tượng gì là $NaCl$
b)
Trích mẫu thử
Đưa nam châm vào mẫu thử :
- mẫu thử nào bị hút là $Fe$
Cho dung dịch $H_2SO_4$ vào mẫu thử :
- mẫu thử nào tan, tạo khí là $Na,Al$
$2Na + H_2SO_4 \to Na_2SO_4 + H_2$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
- mẫu thử nào tạo kết tủa trắng và khí không màu là Ca
$Ca + H_2SO_4 \to CaSO_4 + H_2$
Cho nước vào các mẫu thử :
- mẫu thử tan là Na
$2Na + 2H_2O \to 2NaOH + H_2$
- mẫu thử không tan là Al

Trích mỗi chất một ít ra ống nghiệm làm thuốc thử
Cho quỳ tím lần lượt vào các mẫu thử :
- Hóa đỏ : HCl
- Hóa xanh : KOH
- Không HT : NaNO3 , KCl (1)
Cho dung dịch AgNO3 lần lượt vào các chất ở (1) :
- Kết tủa trắng : KCl
- Không HT : NaNO3
\(AgNO_3+KCl\rightarrow AgCl+KNO_3\)

+ Nhận ra CuO vì có màu đen
Hòa tan các mẫu thử còn lại vào nước rồi dùng nhỏ lên giấy quỳ tím , nhận ra :
P2O5 : vì dung dịch làm quỳ tím chuyển đỏ
P2O5 + 3H2O --> 2H3PO4
NaCl : vì dung dụng không làm quỳ tím chuyển màu
K2O , CaO : vì dung dịch làm quỳ tím chuyển xanh (A)
K2O + H2O --> KOH
CaO + H2O --> Ca(OH)2
Sục khí CO2 vào hai dung dịch trong nhóm A , nhận ra :
CaO :Vì dung dịch tạo kết tủa
Ca(OH)2 + CO2 --> CaCO3 + H2O
KOH : không hiện tượng
Trích mỗi chất một ít ra ống nghiệm làm thuốc thử :
Cho nước lần lượt vào :
- Tan , tạo thành dd : K2O , P2O5 , CaO , NaCl
- Không tan : CuO
Cho quỳ tím vào các dd thu được :
- Hóa đỏ : P2O5
- Hóa xanh : CaO , K2O
- Không HT : NaCl
Cho dd hóa đỏ lần lượt vào các dd hóa xanh :
- Kết tủa trắng : CaO
- Không HT : K2O

_ Trích mẫu thử.
_ Cho vào từng mẫu thử một mẩu Zn.
+ Nếu mẩu Zn tan, có hiện tượng sủi bọt khí, đó là HCl.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
+ Nếu không hiện tượng, đó là K2SO4, K2CO3, Ba(NO3)2. (1)
_ Nhỏ vài giọt dd HCl vừa nhận biết được vào từng mẫu thử nhóm (1).
+ Nếu sủi bọt khí, đó là K2CO3.
PT: \(2HCl+K_2CO_3\rightarrow2KCl+CO_2+H_2O\)
+ Nếu không hiện tượng, đó là K2SO4 và Ba(NO3)2. (2)
_ Nhỏ một lượng K2CO3 vừa nhận biết được vào mẫu thử nhóm (2).
+ Nếu xuất hiện kết tủa trắng, đó là Ba(NO3)2.
PT: \(K_2CO_3+Ba\left(NO_3\right)_2\rightarrow2KNO_3+BaCO_{3\downarrow}\)
+ Nếu không hiện tượng, đó là K2SO4.
_ Dán nhãn.
Bạn tham khảo nhé!
- Cho Fe tác dụng với các dd:
+ Kim loại tan, sủi bọt khí: HCl
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
+ Kim loại không tan: K2SO4, K2CO3, Ba(NO3)2 (1)
- Cho dd HCl dư tác dụng với các dd ở (1)
+ Sủi bọt khí: K2CO3
\(K_2CO_3+2HCl\rightarrow2KCl+CO_2+H_2O\)
+ Không hiện tượng: K2SO4, Ba(NO3)2 (2)
- Cho dd K2CO3 tác dụng với các dd ở (2)
+ Không hiện tượng: K2SO4
+ Kết tủa trắng: Ba(NO3)2
\(K_2CO_3+Ba\left(NO_3\right)_2\rightarrow BaCO_3\downarrow+2KNO_3\)

Thả vào nước và cho thử QT:
- Tan, chuyển xanh -> Na2O
- Tan, QT chuyển đỏ -> P2O5
- Ko tan -> Fe2O3
- Tan ít, QT chuyển xanh -> CaO

- Trích một ít các dd làm mẫu thử, đánh số thứ tự
- Cho 2 dd tác dụng với dd BaCl2
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Na2SO4
Na2SO4 + BaCl2 --> BaSO4\(\downarrow\) + 2NaCl


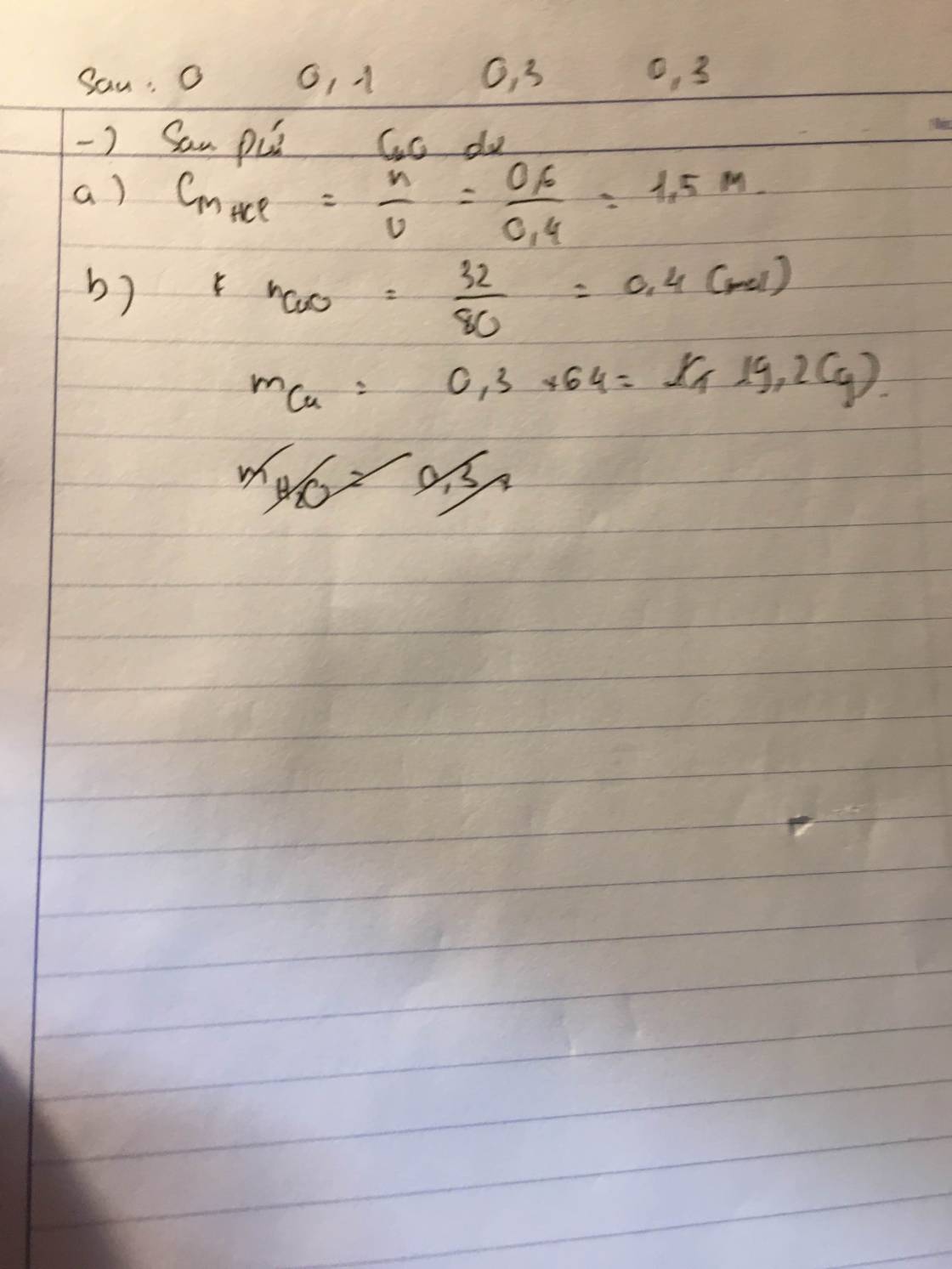
Trích các mẫu thử
Cho các mẫu thử vào nước. Chất rắn nào ko tan thì là Fe2O3, còn lại đều tan được
Nhỏ 3 dung dịch còn lại vào giấy quỳ tím
Nếu quỳ tím chuyển sang màu đỏ thì đó là H3PO4
=>P2O5
Nếu chuyển sang màu xanh thì là hai cái còn lại
Cho CO2 vào, nếu có kết tủa thì là CaO
=>Còn lại là Na2O