Câu 8 Nếu để thanh sắt để ngoài không khí ẩm sau một thời gian khối lượng của thanh sắt sẽ như thế nào so với khối lượng ban đầu ? Giải thích?
b. Một cốc đựng dung dịch axit clohiđric và một viên kẽm được đặt ở đĩa cân A. Trên đĩa cân B đặt các quả cân sao cho kim cân ở ví trí thăng bằng . Bỏ viên kẽm vào cốc a xit, biết rằng có phản ứng xảy ra : Zn + HCl ---> ZnCl2 + H2 . Sau một thời gian phản ứng thì kim cân sẽ lệch về phía nào? Vì Sao?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng thanh sắt tăng lên vì để ngoài trời thanh sắt sẽ bị oxi hóa
3Fe + 2O2 -> Fe3O4
mFe<mFe3O4
Thanh sắt sẽ tăng khối lượng vì có phải ứng với oxi trong không khí.

Đáp án : C
, nCu2+ = 0,2 mol ; nAg+ = 0,1 mol
,mdung dịch giảm = mkim loại tăng = 2g

a, \(2Fe+O_2\underrightarrow{t^o}2FeO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Fe+3O_2\underrightarrow{t^o}2Fe_2O_3\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
\(Fe_2O_3+3H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3H_2O\)
b, Ta có: mO2 = 3,2 (g) \(\Rightarrow n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: 3nFe = 4nO2 + 2nSO2
⇒ nFe = 0,2 (mol)
⇒ mFe = 0,2.56 = 11,2 (g)

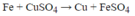
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam khối lượng dung dịch giảm so với ban đầu 0,8 gam
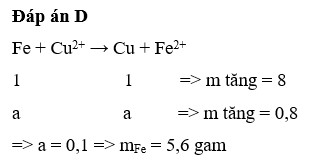
a) khối lượng thanh sắt tăng
vì có phản ứng 3Fe + 3O2 ➝ Fe3O4
có thêm O bám vào nên khối lượng tăng
b) theo bảo toàn khối lượng thì
mZn + mHCl = mZnCl2 + mH2
nhưng do H2 là khí nên H2 thoát ra vì vậy dung dịch sau phản ứng chỉ còn ZnCl2, kết luận là đĩa cân A nặng hơn