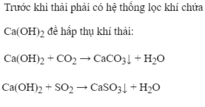Khí CO2, SO2 do các nhà máy thải ra gây ô nhiễm không khí rất nặng. Em hãy nêu lên cách để loại bỏ bớt lượng khí trên trước khi thải ra môi trường. Viết 1 phương trình phản ứng minh họa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()


\(Ca\left(OH\right)_{2\left(dư\right)}+CO_2\rightarrow CaCO_3\downarrow+H_2O\\ Ca\left(OH\right)_{2\left(dư\right)}+SO_2\rightarrow CaSO_3\downarrow+H_2O\)

Có thể dẫn các khí qua dung dịch kiềm dư, dễ điều chế và tìm thấy nhất là NaOH để loại bỏ các khí trên.
\(2NaOH+CO_2->Na_2CO_3+H_2O\\ 2NaOH+SO_2->Na_2SO_3+H_2O\)

(3) Các dạng nhiên liệu như than, dầu mỏ và khí tự nhiên được gọi là nhiên liệu hóa thạch.
(4) Khi được thải ra khí quyển, freon (chủ yếu là CFCl3 và CF2Cl2) phá hủy tầng ozon.
(5) Các nguồn năng lượng: thủy điện, gió, mặt trời đều là những nguồn năng lượng sạch.
(6). Khí thải sinh hoạt, khí thải công nghiệp gây ô nhiễm không khí.
(7). Khí thải của các phương tiện giao thông gây ô nhiễm không khí
(9). Hoạt động của núi lửa gây ô nhiễm không khí.
ĐÁP ÁN A

a) Phương trình phản ứng giữa SO2 và H2S là:
SO2 + H2S -> 2H2O + 3S b) Để tính số lít H2S cần thiết, ta cần biết số mol SO2 sinh ra từ việc đốt cháy 2,0 tấn than chứa sulfur. - Khối lượng sulfur trong 2,0 tấn than = 2,0 tấn x 3,5% = 70 kg.- Số mol sulfur = khối lượng sulfur / khối lượng mol sulfur = 70 kg / 32,06 g/mol = 2180,5 mol.- Vì phản ứng xảy ra hoàn toàn, số mol H2S cần thiết cũng là 2180,5 mol.- Theo phương trình phản ứng, ta thấy tỉ lệ mol giữa SO2 và H2S là 1:1.- Vậy, số lít H2S cần thiết là 2180,5 lít.