Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a, Viết PTHH?
b, Nếu dùng 0,1 mol mỗi chất trên thì thể tích khí oxi thu được có khác nhau không? Tính V khí oxi?
c, Cần điều chế 1,12 lít khí oxi, tính khối lượng mỗi chất cần dùng?

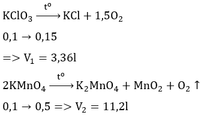
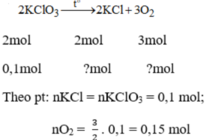
a) 2KClO3 \(\underrightarrow{to}\) 2KCl + 3O2 (1)
2KNO3 \(\underrightarrow{to}\) 2KNO2 + O2 (2)
b) Theo PT1: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}\times0,1=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}\left(1\right)=0,15\times22,4=3,36\left(l\right)\)
Theo PT2: \(n_{O_2}=\dfrac{1}{2}n_{KNO_3}=\dfrac{1}{2}\times0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}\left(2\right)=0,05\times22,4=1,12\left(l\right)\)
Vậy nếu dùng 0,1 mol mỗi chất trên thì thể tích khí oxi thu được khác nhau
c) \(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT1: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}\times0,05=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{30}\times122,5=4,083\left(g\right)\)
Theo PT2: \(n_{KNO_3}=2n_{O_2}=2\times0,05=0,1\left(mol\right)\)
\(\Rightarrow m_{KNO_3}=0,1\times101=10,1\left(g\right)\)