Đốt cháy 3,1g photpho trong không khí thu được 5g P2O5. Tính hiệu suất phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\dfrac{3.1}{31}=0.1\left(mol\right)\)
\(n_{O_2}=\dfrac{5}{32}=0.15625\left(mol\right)\)
\(4P+5O_2\underrightarrow{t^0}2P_2O_5\)
\(0.1...0.125......0.05\)
\(m_{O_2\left(dư\right)}=\left(0.15625-0.125\right)\cdot32=1\left(g\right)\)
\(m_{P_2O_5}=0.05\cdot142=7.1\left(g\right)\)
a,
số mol của P là:nP=3,1/31=0,1(mol)
số mol của Oxi là:no=5/32=0,15625(mol)
ta có PTPU: 4 P+ 5O2= 2P2O5 (1)
trước p/ư : 0,1 0,15625 mol
phản ứng : 0,1 0,125 0.05 mol
sau p/ư : 0 0,03125 0,05 mol
=>Oxi dư sau phản ứng
khối lượng oxi dư là: mO2=0.03125 x 32= 1g
b,theo p/ư (1),tc : nP2O5= 2/4 nP=2/4 x 0,1=0.05 mol
mP2O5= 0.05 x 142=7,1g

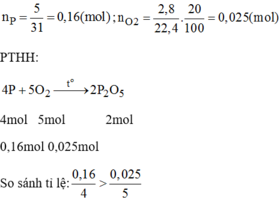
Vậy P dư nen tính bài toán theo n O 2
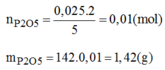
Khối lượng P 2 O 5 thực tế thu được: 1,42.80% = 1,136(g)

\(n_{H_3PO_4}=\dfrac{9,8}{98}=0,1(mol)\\ PTHH:4P+5O_2\xrightarrow{t^o}2P_2O_5\\ P_2O_5+3H_2O\to 2H_3PO_4\\ \Rightarrow n_{P}=2n_{P_2O_5}=n_{H_3PO_4}=0,1(mol)\\ \Rightarrow m_{P(phản ứng)}=0,1.31=3,1(g)\\ \Rightarrow H\%=\dfrac{3,1}{7,75}.100\%=40\%\)

a)
\(n_{P_2O_5} = \dfrac{42,6}{142} = 0,3(mol)\\ \)
4P + 5O2 \(\xrightarrow{t^o}\) 2P2O5
0,6.............0,75.................0,3..........(mol)
mP = 0,6.31 = 18,6(gam)
b)
2KClO3 \(\xrightarrow{t^o}\) 2KCl + 3O2
0,5....................................0,75.....(mol)
\(m_{KClO_3} = 0,5.122,5 = 61,25(gam)\)
c)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
\(n_{Fe} = \dfrac{16,8}{56} = 0,3(mol)\\ \dfrac{n_{Fe}}{3} = 0,1 < \dfrac{n_{O_2}}{2} = 0,375\)
nên hiệu suất tính theo số mol Fe.
\(n_{Fe\ pư} = 0,3.90\% = 0,27(mol)\\ n_{Fe_3O_4} =\dfrac{1}{3}n_{Fe\ pư} = 0,09(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,09.232 = 20,88(gam)\)

\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,4}{5}\Rightarrow O_2dư\)
\(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\ n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(n_{P_2O_5\left(lt\right)}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{P_2O_5\left(lt\right)}=0,1.142=14,2\left(g\right)\\ m_{P_2O_5\left(tt\right)}=0,1.142.80\%=11,36\left(g\right)\)

\(n_{O_2\left(đktc\right)}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 4P+5O_2\underrightarrow{^{to}}2P_2O_5\\ 0,12........0,15.........0,06\left(mol\right)\\ m_P=0,12.31=3,72\left(g\right)\)

nP = 3,1 / 31 = 0,1 mol
PTHH: 4P + 5O2 ===> 2P2O5
0,1mol 0,05 mol
Lập các số mol theo PTHH, ta có
nP2O5(phương trình) = 0,05 mol
=> mP2O5 ( phương trình) = 0,05 x 142 = 7,1 gam
Mà thực tế thu đc 8 gam P2O5
=> \(H=\dfrac{5}{7,1}\cdot100\%=70,42\%\)