Tính thể tích thu được(ĐKTC) khi cho 13g zn tác dụng với HCl dư. Tính khối lượng muối sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
nZn = \(\dfrac{13}{65}=0,2mol\)
Theo pt: nH2 = nZn = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48 lít
b) Theo pt: nZnCl2 = nZn = 0,2 mol
=> mZnCl2 = 0,2.136 = 27,2g

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Ta thấy : \(\dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15\) nên Zn dư.
Theo PTHH :
\(n_{Zn\ pư} = 0,5n_{HCl} = 0,15(mol)\\ \Rightarrow n_{Zn\ dư} = 0,2 - 0,15 = 0,05(mol)\\ \Rightarrow m_{Zn\ dư} = 0,05.65 = 3,25(gam)\)
c)
Ta có :
\(n_{H_2} = n_{Zn\ pư} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{35}=0,5\left(mol\right)\\ a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,5}{2}>\dfrac{0,2}{1}\Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,5-0,2.2=0,1\left(mol\right)\\ m_{HCl}=0,1.36,5=3,65\left(g\right)\\ c.n_{ZnCl_2}=n_{Zn}=n_{H_2}=0,2\left(mol\right)\\ m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,5 0,2 0,2
b) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
⇒ Zn phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{HCl\left(dư\right)}=0,5-\left(0,2.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
c) \(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
Chúc bạn học tốt

\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2....................0.2..........0.2\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)

\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=2\cdot0,15=0,3\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên sau p/ứ Zn dư
\(\Rightarrow n_{Zn}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\\ \Rightarrow m_{Zn}=0,15\cdot65=9,75\\ \Rightarrow m_{Zn\left(dư\right)}=13-9,75=3,25\left(g\right)\\ c,n_{H_2}=n_{Zn}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=n_{ZnCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a) Zn + 2HCl → ZnCl2 + H2
b) mZnCl2 = 0,1 . 136 = 13,6 gam
c) nZn = 6,5/65 = 0,1 mol . Theo tỉ lệ pư => nH2 = nZn = nZnCl2 =0,1 mol <=> VH2(đktc) = 0,1.22,4 = 2,24 lít.

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{100\cdot14.6\%}{36.5}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1........2\)
\(0.1......0.4\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.4}{2}\Rightarrow HCldư\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.5+100-0.1\cdot2=106.3\left(g\right)\)
\(C\%ZnCl_2=\dfrac{0.1\cdot136}{106.3}\cdot100\%=12.79\%\)
\(C\%HCl\left(dư\right)=\dfrac{\left(0.4-0.2\right)\cdot36.5}{106.3}\cdot100\%=6.87\%\%\)

a, \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(m_{HCl}=36,5.15\%=5,475\left(g\right)\Rightarrow n_{HCl}=\dfrac{5,475}{36,5}=0,15\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,15}{2}\), ta được Mg dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow V_{H_2}=0,075.22,4=1,68\left(l\right)\)
b, \(n_{Mg\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow n_{Mg\left(dư\right)}=0,1-0,075=0,025\left(mol\right)\)
\(\Rightarrow m_{Mg\left(dư\right)}=0,025.24=0,6\left(g\right)\)
c, - Cách 1:
\(n_{MgCl_2}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow m_{MgCl_2}=0,075.95=7,125\left(g\right)\)
- Cách 2:
Theo ĐLBT KL, có: mMg (pư) + mHCl = mMgCl2 + mH2
⇒ mMgCl2 = 2,4 - 0,6 + 5,475 - 0,075.2 = 7,125 (g)
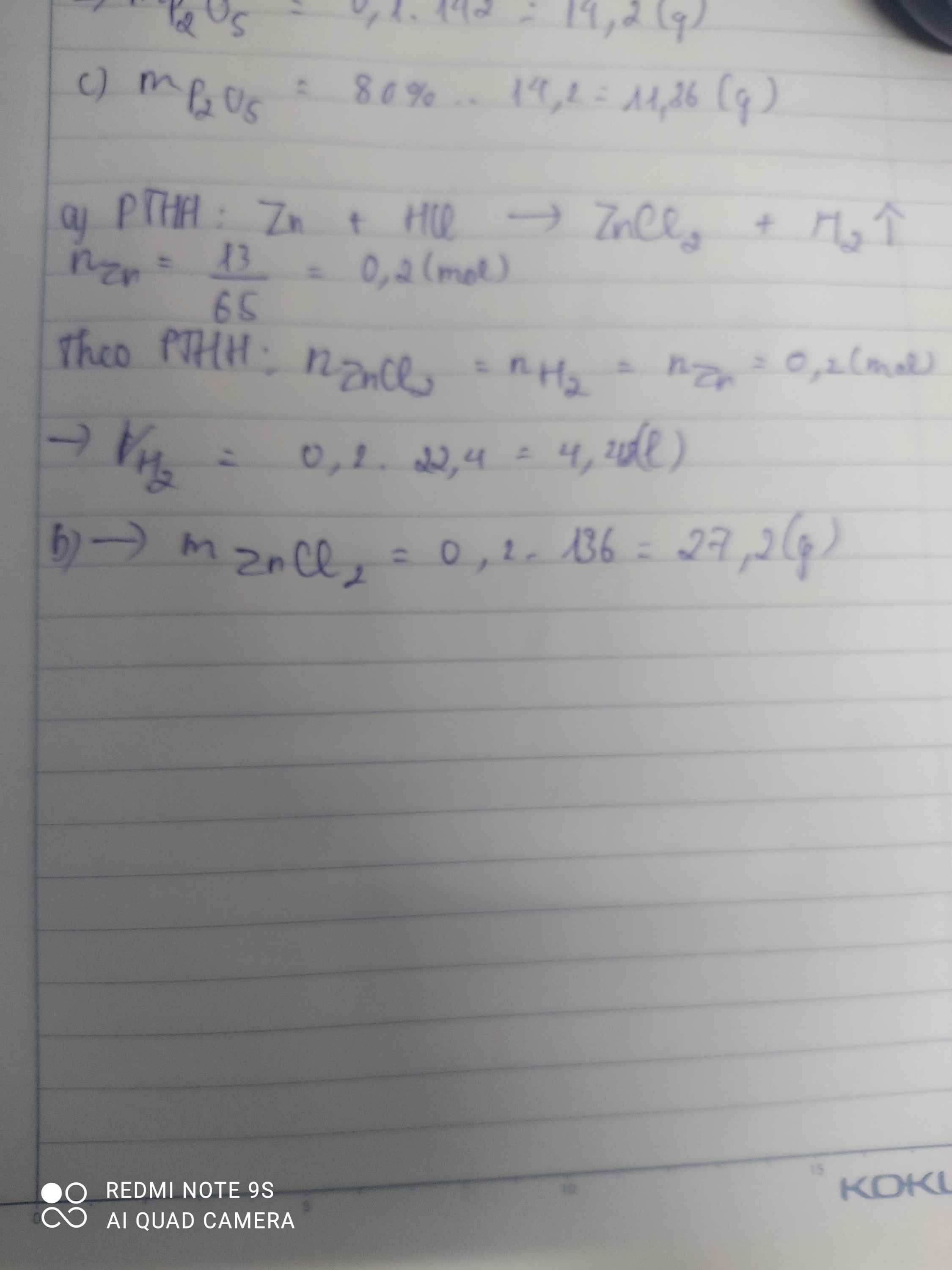
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,2 0,2
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
\(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
Chúc bạn học tốt