Cho 16g kẽm tác dụng vừa đủ với axit Sunfuric theo phương trình
Zn+ HCl -> ZnCl2 + H2
a)Tính số mol Zn và lập phương trinh phản ứng
b)Tính thể tích H2 thoát ra(đktc)
c)Tính khối lượng axit clohidric (HCl)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

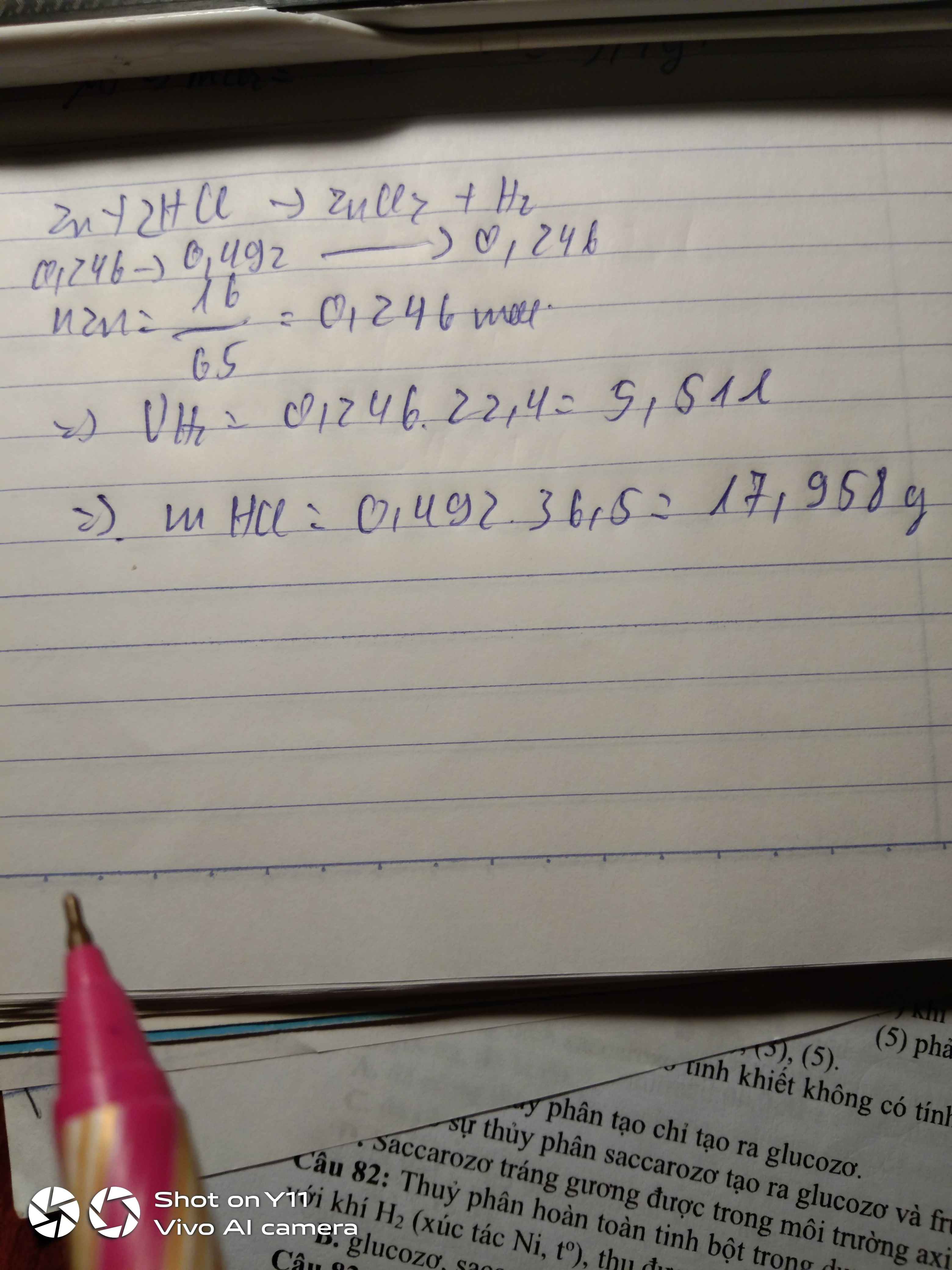

a: Zn+2HCl->ZnCl2+H2 bay lên
b: n Zn=16/64=0,25mol
=>nZnCl2=0,25mol
=>nHCl=0,5mol
=>nH2=0,25mol
V=0,25*22,4=5,6(lít)
c: mHCl=0,5*36,5=18,25g
d: Số phân tử là:
0,25*6,02*10^23=1,505*10^23 phân tử

Zn + 2HCl -> ZnCl2 + H2
a)nZn=\(\frac{13}{65}\)=0,2(mol)
Theo PTHH ta có:
nH2=nZn=0,2(mol)
nHCl=2nZn=0,4(mol)
b)VH2=22,4.0,2=4,48(lít)
c)mHCl=36,5.0,4=14,6(g)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4------------>0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c) mHCl = 0,4.36,5 = 14,6 (g)
nZn = 13 : 65 = 0,2 (mol)
pthh : Zn + 2HCl --> ZnCl2 + H2
0,2 ------------> 0,2 ---->0,2 (mol)
VH2 = 0,2 . 22,4 = 4,48 (l)
mZnCl2 = 0,2 . 36,5 = 14,6 (g)

a) Số mol kẽm tham gia phản ứng : \(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{16,25}{65}=0,25\left(mol\right)\).
PTHH : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Mol : 1 : 2 : 1 : 1
Mol : 0,25 → 0,5 → 0,25 → 0,5
Suy ra, số mol dung dịch Axit Clohidric \(HCl\) tham gia phản ứng là \(n_{HCl}=0,5\left(mol\right)\).
Khối lượng dung dịch đã dùng : \(m_{HCl}=n_{HCl}.M_{HCl}=\left(0,5\right).\left(36,5\right)=18,25\left(g\right)\).
b) Từ câu a, suy ra số mol khí Hidro sinh ra là \(n_{H_2}=0,25\left(mol\right)\).
Thể tích khí Hydro sinh ra là : \(V_{H_2}=n_{H_2}.22,4=\left(0,25\right).\left(22,4\right)=5,6\left(l\right)\)