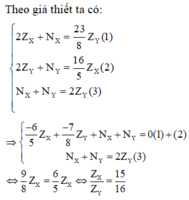Bài tập : cấu hình electron ng\cùng của ngtố X là 5p^5.Tỉ số nơtron và điện tích hạt nhân là 1,3962.Số nơtron của X bằng 3,7 lần số nơtron của ng tử thuộc ng tố Y.Khi cho 4,29 g Y phản ứng vs lượng dư X thì thu được 18,26 g sản phẩm.Tìm số hiệu ng tử của Y (Biết phản ứng: Y + X2 -> YX). Ai biết giải giúp em vs, em xin cảm ơn ạ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Cấu hình electron phân lớp ngoài cùng của nguyên tố X là 5p5
Cấu hình electron của X là 1s22s22p63s23p63d104s24p64d105s25p5 (Z X = 53)
Tỉ lệ số notron và điện tích hạt nhân là 1,3962 → nX = 74 → AX = 74 + 53 = 127
Số notron trong X gấp 3,7 lần số notron trong Y → nY = 20
Phương trình hóa học : X + Y → XY
Bảo toàn khối lượng → mX = 4,565 - 1,0725 = 3,4925 gam
Theo phương trình có
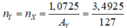
→ AY= 39 → ZY = 39 - 20 = 19
Cấu hình của Y là [Ar]4s1
Số hiệu nguyên tử của X là 53 → A đúng
Y có 4 electron và có 1 electron lớp ngoài cùng → B, C đúng
Số khối của X là 127 → D sai

Đặt ZX, NX lần lượt là số proton và notron của nguyên tử X
X có điện tích hạt nhân là 53 => ZX = 53
Có : \(\frac{N_X}{Z_X}=1,3962\Rightarrow N_X=1,3962.Z_X=1,3962.53=74\)
=> Số khối của X là: AX = ZX + NX = 53 + 74 = 127 => X là Iot
\(\text{Có: NY = NX : 3,7 = 74:3,7 = 20 (hạt)}\)
\(\text{X + Y → XY (1)}\)
Bảo toàn khối lượng có: mX + mY = mXY
\(\text{→ mX = 4,565 – 1,0725 = 3,4925 (g)}\)
\(\text{→ nX = mX : MX = 3,4925 : 127 = 0,0275 (mol)}\)
Theo PTHH (1): nY = nX = 0,0275 (mol)
=> MY = mY : nY = 1,0725 : 0,0275 = 39 (g/mol)
=> ZY = MY – NY = 39 – 20 = 19
Y là nguyên tố Kali

Đáp án A
Theo giả thiết ta có:
2 Z X + N X = 23 8 Z Y ( 1 ) 2 Z Y + N Y = 16 5 Z X ( 2 ) N X + N Y = 2 Z Y ( 3 )
⇒ - 6 5 Z X + - 7 8 Z Y + N X + N Y = 0 ( 1 ) + ( 2 ) N X + N Y = 2 Z Y ( 3 )
⇔ 9 8 Z X = 6 5 Z X ⇔ Z X Z Y = 15 16

\(\left\{{}\begin{matrix}P=E\\\dfrac{N}{N+P}=\dfrac{11}{20}\\P+E+N=58\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=58\\20N-11N-11P=0\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}2P+N=58\\9N-11P=0\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=18\\N=22\end{matrix}\right.\\ \Rightarrow A=Z+N=18+22=40\left(đ.v.C\right)\\ \Rightarrow KH:^{40}_{18}Ar\)