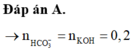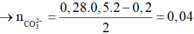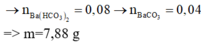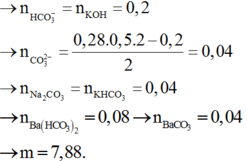Thêm dần dung dịch KOH 33,6% vào 40ml dung dịch HNO3 37,8% ( d=1,25gam/ml) đến khi trung hòa vừa hết axit thu được dung dịch A . Đưa A về 0 độ C thấy tách ra 20,55g tinh thể X và dung dịch còn lịa có nồng độ 19,07%. Xác định công thức tinh thể X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án:
21,15(gam)21,15(gam)
Giải thích các bước giải:
mdung dịch HNO3=D.V=1,24.40,3=50(gam)mdung dịch HNO3=D.V=1,24.40,3=50(gam)
⇒nHNO3=50.37,8%63=0,3(mol)⇒nHNO3=50.37,8%63=0,3(mol)
HNO3+KOH→KNO3+H2OHNO3+KOH→KNO3+H2O
Theo PTHH :
nKNO3=nKOH=nHNO3=0,3(mol)nKNO3=nKOH=nHNO3=0,3(mol)
⇒mdd KOH=0,3.5633,6%=50(gam)⇒mdd KOH=0,3.5633,6%=50(gam)
Muối tách ra là KNO3KNO3
Gọi nKNO3(tách ra)=x(mol)nKNO3(tách ra)=x(mol)
Sau khi tách muối :
nKNO3=0,3−x(mol)nKNO3=0,3−x(mol)
mdd=mdd KOH+mdd HNO3−mKNO3(bị tách)mdd=mdd KOH+mdd HNO3−mKNO3(bị tách)
=50+50−101x=100−101x(gam)=50+50−101x=100−101x(gam)
⇒C%KNO3=(0,3−x).101100−101x.100%=11,6%⇒C%KNO3=(0,3−x).101100−101x.100%=11,6%
⇒x=0,2094(mol)⇒x=0,2094(mol)
Suy ra : m=0,2094.101=21,15(gam)

PTHH: \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
mdd của HNO3= 1,24.40,3=50 gam
=> mHNO3 = \(\dfrac{50.37,8}{100}=18,9gam\) ( đây là khối lượng chất tan HNO3)
=> \(n_{HNO_3}=\dfrac{18,9}{63}=0,3mol\)
theo PTHH => \(n_{KOH}=0,3mol\)
=> \(m_{KOH}=0,3.56=16,8gam\)
=> khối lượng dung dịch KOH tham gia phản ứng:
\(\dfrac{16,8}{33,6}.100=50gam\)
=> Tổng khối lượng dung dịch sau phản ứng là
50 + 50 =100 gam dung dịch
Theo PTHH=> \(n_{KNO_3}=0,3mol=>m_{KNO_3}=0,3.101=30,3gam\)
Khi hạ nhiệt độ của dung dịch về 00C thì thu được dd có nồng độ 11,6 % nên ta có:
\(\dfrac{30,3-m}{100-m}.100\%=11,6\%\)
Giải phương trình trên ta nhận được m=21,15 gam
vậy m= 21,15 gam
b) Dung dịch B là dung dịch đã bão hòa !
a) \(n_{HNO_3}=\dfrac{37,8\left(40,3\cdot1,24\right)}{100\cdot63}=0,3\left(mol\right)\)
KOH + HNO3 \(\rightarrow\)KNO3 + H2O
0,3-----0,3----------0,3
\(m_{ddKOH}=\dfrac{56\cdot0,3\cdot100}{33,6}=50\left(g\right)\)
\(m_{ddHNO_3}=40,3\cdot1,24=50\left(g\right)\)
\(m_{KNO_3}=0,3\cdot101=30,3\left(g\right)\)
Dựa vào đề bài ta có phương trình :
\(\dfrac{30,3-m}{\left(50+50\right)-m}=\dfrac{11,6}{100}\Rightarrow m=21,15\left(g\right)\)
b) Dung dịch B là dung dịch bão hòa ở 0oC

2CH3COOH+Mg->(CH3COO)2Mg+H2
0,02---------------0,01-------0,01----------0,01
n muối=0,01mol
=>CM=\(\dfrac{0,02}{0,04}=0,5M\)
=>VH2=0,01.22,4=0,224l
CH3COOH+NaOH->CH3COONa+H2O
0,02--------------0,02
=>VNaOH=\(\dfrac{0,02}{0,75}=0,03l\)
a) \(n_{\left(CH_3COO\right)_2Mg}=\dfrac{1,42}{142}=0,01\left(mol\right)\)
PTHH: Mg + 2CH3COOH --> (CH3COO)2Mg + H2
0,01<-------0,02<------------0,01------->0,01
=> \(C_{M\left(dd.CH_3COOH\right)}=\dfrac{0,02}{0,04}=0,5M\)
b) VH2 = 0,01.22,4 = 0,224 (l)
c)
PTHH: NaOH + CH3COOH --> CH3COONa + H2O
0,02<------0,02
=> \(V_{dd.NaOH}=\dfrac{0,02}{0,75}=\dfrac{2}{75}\left(l\right)=\dfrac{80}{3}\left(ml\right)\)

\(a,PTHH:KOH+HNO_3\rightarrow KNO_3+H_2O\\ b,n_{HNO_3}=3\cdot0,15=0,45\left(mol\right)\\ \Rightarrow n_{KOH}=n_{HNO_3}=0,45\left(mol\right)\\ \Rightarrow m_{CT_{KOH}}=0,45\cdot56=25,2\left(g\right)\\ \Rightarrow m_{dd_{KOH}}=\dfrac{25,2\cdot100\%}{25\%}=100,8\left(g\right)\\ c,V_{dd_{KOH}}=\dfrac{m_{dd_{KOH}}}{D}=\dfrac{100,8}{2,12}\approx47,5\left(ml\right)\)

Hoà tan hoàn toàn hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X (NaOH dư,NaAlO2)
Chú ý thứ tự các phản ứng khi thêm dung dịch HCl vào dung dịch X
HCl + NaOH → NaCl + H2O (1)
NaAlO2+ HCl+ H2O → NaCl + Al(OH)3 (2)
Al(OH)3 + 3HCl → AlCl3 + 3H2O (3)
Khi thêm 0,1 mol HCl thì bắt đầu xuất hiện kết tủa → nNaOH dư = 0,1 mol (xảy ra (1))
Khi thêm 0,2 mol HCl thì xảy ra (1), (2) ( lượng AlO2- trong pt (2)dư )
→ nkết tủa = nH+ phản ứng (2) = 0,2 - 0,1 = 0,1 mol → a = 7,8 gam. Loại B,D
Khi thêm 0,6 mol HCl xảy ra hiện tượng hòa tan kết tủa (xảy ra cả 3 phương trình)
→ 4×nAlO2- = 3nkết tủa + (nH+ -0,1) → nAlO2- = 0,2 mol
Vậy NaAlO2 0,2 mol, NaOH dư 0,1 mol → m= mAl2O3 + mNa2O = 0,1×102 + 0,15×62 = 19,5 gam
Đáp án A

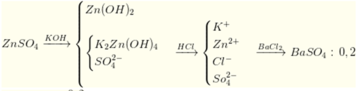
⇒ n Z n S O 4 = 0 , 2 n Z n ( O H ) 2 = 0 , 05 ⇒ n K O H = 0 , 05 . 2 + ( 0 , 2 - 0 , 05 ) 4 = 0 , 7 ⇒ x = 3 , 5
Đáp án D