Hòa tan hoàn tàn 6,2 gam Na2O vào 500 gam dung dịch CuSO4 thu được tối đa kết tủa X. Phân hủy nhiệt hết X thu được chất rắn Y
a) Viết phương trình phản ứng xảy ra
b) Tính khối lượng Y
c) Tính thể tích CO (đktc) cần để phản ứng hoàn toàn Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,2NaOH+MgSO_4\rightarrow Mg\left(OH\right)_2+Na_2SO_4\\ n_{NaOH}=0,5.1=0,5\left(mol\right)\\ b,n_{Mg\left(OH\right)_2}=\dfrac{0,5}{2}=0,25\left(mol\right)=n_{Na_2SO_4}\\ m_{kt}=m_{Mg\left(OH\right)_2}=58.0,25=14,5\left(g\right)\\ c,V_{ddX}=V_{ddNaOH}+V_{ddMgSO_4}=0,5+0,5=1\left(l\right)\\ C_{MddNa_2SO_4}=\dfrac{0,25}{1}=0,25\left(M\right)\)

bạn xem lại xem 13.5(g) hay 13.8g nhé ^^ ,cho tròn số ý mà
CuCl2+2NaOH->Cu(OH)2+2NaCl
nCuCl2=13.5:138=0.1(mol)
nNaOH=20:40=0.5(mol)
theo pthh:nNaOH=2nCuCl2
theo bài ra,nNaOH=5 nCuCl2->NaOH dư tính theo CuCl2
theo pthh,nCu(OH)2=nCuCl2->nCu(OH)2=0.1(mol)
mCu(OH)2=0.1*98=9.8(g)
b)PTHH:Cu(OH)2+2HCl->CuCl2+2H2O
theo pthh:nHCl=2nCu(OH)2->nHCl=0.1*2=0.2(mol)
mHCl=0.2*36.5=7.3(g)
mDD HCl=7.3*100:10=73(g)
\(a,PTHH:CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+2NaCl\\ Cu\left(OH\right)_2\rightarrow^{t^o}CuO+H_2O\)
Hiện tượng: Dung dịch màu xanh nhạt dần, xuất hiện kết tủa màu xanh lơ
Phản ứng phân hủy Cu(OH)2 sinh ra chất rắn CuO màu đen và nước
\(b,n_{CuCl_2}=\dfrac{13,5}{135}=0,1\left(mol\right)\\ m_{NaOH}=\dfrac{200\cdot2,5\%}{100\%}=5\left(g\right)\\ \Rightarrow n_{NaOH}=\dfrac{5}{40}=0,125\left(mol\right)\)
Vì \(\dfrac{n_{CuCl_2}}{1}>\dfrac{n_{NaOH}}{2}\) nên CuCl2 dư
\(\Rightarrow\dfrac{1}{2}n_{NaOH}=n_{Cu\left(OH\right)_2}=n_{CuO}=0,0625\left(mol\right)\\ \Rightarrow m=m_{CuO}=0,0625\cdot80=5\left(g\right)\)
\(c,n_{NaCl}=n_{NaOH}=0,125\left(mol\right)\\ \Rightarrow m_{NaCl}=0,125\cdot58,5=7,3125\left(g\right)\\ m_{Cu\left(OH\right)_2}=0,0625\cdot98=6,125\left(g\right)\\ \Rightarrow m_{dd_{Cu\left(OH\right)_2}}=13,5+200-7,3125=206,1875\left(g\right)\\ \Rightarrow C\%_{Cu\left(OH\right)_2}=\dfrac{6,125}{206,1875}\cdot100\%\approx2,97\%\)

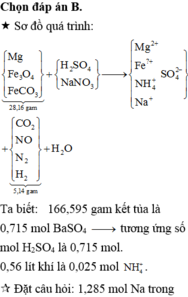
Đáp án B
Sơ đồ quá trình:
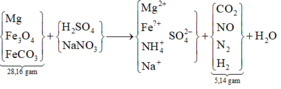

Đặt câu hỏi: 1,285 mol Na trong NaOH thêm vào và Na trong NaNO3 sẵn có cuối cùng đi về đâu?
À, về hết trong 0,715 mol Na2SO4 → số mol NaNO3 ban đầu là 0,715 x 2 – 1,285 = 0,415 mol
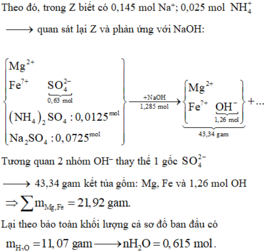
Giải hệ hỗn hợp khí Y gồm CO2, N2, NO và 0,05 mol H2; biết tổng mol Y là 0,2; nặng 5,14 gam.


Đáp án : B
Vì kim loại tan hết nên HNO3 dư
Khi X + KOH => thu được kết tủa
+) Giả sử KOH dư => chất rắn 16,0g gồm Fe2O3 ; CuO (*)
Khi đó T gồm KNO3 và KOH => Nung lên thành KNO2 và KOH với số mol lần lượt là x và y
=> 41,05 = 85x + 56y
Và nK = 0,5 = x + y
=> x = 0,45 mol ; y = 0,05 mol
Gọi số mol Fe và Cu trong A lần lượt là a và b mol
=> 56a + 64b = 11,6g
Và 80a + 80b = 16g (*)
=> a = 0,15 mol ; b = 0,05 mol
+) Nếu chỉ có Fe3+ và Cu2+ => nKOH < 3nFe + 2nCu ( Vô lí )
=> Trong X có Fe2+ : u mol và Fe3+ : v mol
=> HNO3 phải hết
=> u + v = 0 , 15 2 u + 3 v = 0 , 45 => u = 0 , 1 v = 0 , 05
Có nFe(NO3)3 = 0,05 mol
Ta thấy mN2 < mB < mNO2
=> 0,35.28 < mB < 46.0,7
=> 9,8 < mB < 32,2g
BTKL : 66,9g < mdd sau < 89,3g
=> 13,55% < %mFe(NO3)3 < 18,09%

Đáp án B
► Giả sử KOH không dư ||⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ||⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g) || 16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16 ||⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
||⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol ||⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%



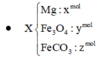
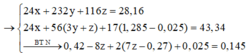
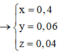



PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
\(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\)
Ta có: \(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)=n_{Cu\left(OH\right)_2}=n_{CuO}=n_{CO}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,1\cdot80=8\left(g\right)\\V_{CO}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)