Bài 1
Có một loại oxit sắt dùng để luyện gang. Nếu khử a gam oxit sắt này bằng cacbon oxit ở nhiệt độ cao người ta thu được 0,84 gam sắt và 0,448 lít khí cacbonic (đktc). Công thức hoá học của loại oxit sắt nói trên là:
Bài 2
Nung 2,10g bột sắt trong bình chứa oxi, đến khi phản ứng xảy ra hoàn toàn thu được 2,90g một oxit. Công thức phân tử của oxit sắt là công thức nào sau đây:
Bài 3
Cho oxit sắt X hòa tan hoàn toàn, trong dd HCl, thu được dd Y chứa 1,625 g muối sắt cloruA. Cho dd Y tác dụng hết với dd AgNO3 thu được 4,305 g kết tủA. X có công thức nào sau đây?
Bài 4
Đốt cháy 1 mol sắt trong oxi được 1 mol oxit sắt. Công thức phân tử của oxi sắt này là:
Bài 5
Khử hoàn toàn một oxit sắt nguyên chất bằng CO dư ở nhiệt độ cao. Kết thúc phản ứng, khối lượng chất rắn giảm đi 27,58%. Oxit sắt đã dùng là:


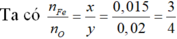
1) nAgCl = 0,03 mol = nCl trong muối sắt
=> mCl = 1,065g => mFe = m muối - mCl = 1,625 - 1,065 = 0,56g
=> nFe = 0,01 mol
nFe : nCl = 1:3 => FeCl3
2) nOH- : nH3PO4 = 1,375 => muối tạo thành là NaH2PO4 và Na2HPO4
Gọi số mol NaH2PO4 và Na2HPO4 lần lượt là a, b. Ta có hệ:
bảo toàn Na: a + 2b = 0,0275
Bảo toàn P: a + b = 0,02
=> a, b
Bài 1
Fe3O4
Bài 2
Fe3O4
Bài 3
Fe2O3
Bài 4
FeO
Bài 5
Fe3O4