Cần bn lít dd NaOH 3% có D=1,05g/ml và bn lít đ NaOH 10% có D=1,12g/ml để pha chế đc 2 lít đ NaOH 8% có D=1,1 g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(TC:\)
\(V_1+V_2=2\left(l\right)\)
\(m_{dd_{NaOH\left(3\%\right)}}=1.05V_1\left(g\right)\)
\(m_{NaOH\left(3\%\right)}=1.05V_1\cdot3\%=0.0315V_1\left(g\right)\)
\(m_{dd_{NaOH\left(10\%\right)}}=1.12V_2\left(g\right)\)
\(m_{NaOH\left(10\%\right)}=1.12V_2\cdot10\%=0.112V_2\left(g\right)\)
\(m_{NaOH\left(8\%\right)}=2000\cdot1.1\cdot8\%=176\left(g\right)\)
\(\Leftrightarrow0.0315V_1+0.112V_2=176\left(2\right)\)
\(\left(1\right),\left(2\right):V_1=596\left(ml\right),V_2=1404\left(ml\right)\)
Gọi V dd NaOH 3% = a(lít) ; V dd NaOH 10% = b(lít)
Ta có : a + b = 2(1)
Áp dụng CT : m dd = D.V
m dd NaOH 3% = a.1,05.1000 = 1050a(gam)
m dd NaOH 10% = b.1,12.1000 = 1120b(gam)
m dd NaOH 8% = 2.1,1.1000 = 2200(gam)
Sau khi pha :
m NaOH = 1050a.3% + 1120b.10% = 2200.8%(2)
Từ (1)(2) suy ra a = 0,596(lít) = 596(ml) ; b = 1,404(lít) = 1404(ml)

1) Gọi thể tích các dung dịch NaOH có nồng độ 3% và 10% cần dùng lần lượt là V_1 và V_2.
m_NaOH 3%= 1,05(V_1)3%= 0,0315V_1.
m_NaOH 10% =1,12(V_2)10%= 0,112V_2.
m_NaOH 8%= 1,1.2000.8% =176.
Theo đề bài ta có hệ phương trình:
0,0315V_1 + 0,112V_2= 176 ∩ V_1+ V_2 =2000 => V_1= 96000/161 (mℓ), V_2= 226000/161 (mℓ).

* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
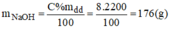
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
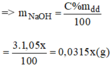
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
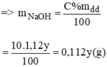
Ta có hệ phương trình sau: 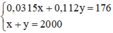
Giải hệ phương trình trên, ta được: 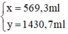
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

Câu 3
Gọi V1,V2 lần lượt là thể tích của dd NaOH 3% và dd NaOH
10% cần dùng để pha chế dd NaOH 8%
Khối lượng dd NaOH 3% là 1,05.V1 (g)
- - > số mol của NaOH 3% là nNaOH = 1,05.V1.3/(100.40)
khối lượng dd NaOH 10% là 1,12.V2(g)
- - > Số mol của NaOH 10% là nNaOH = 1,12.V2.10/(100.40)
Khối lượng dd NaOH 8% là 2.1,11 = 2200(g)
- -> Số mol của NaOH 8% tạo thành là nNaOH
=2200.8/(100.40) = 4,4mol
Ta có hệ phương trình
{1,05V1 + 1,12V2 = 2200
{1,05.V1.3/(100.40) + 1,12.V2.10/(100.40) = 4,4
giải hệ này ta được
V1 = 598,6 (ml) ~0,6 (l)
V2 = 1403,06(ml) ~ 1,4 (l)

1) Gọi thể tích các dung dịch NaOH có nồng độ 3% và 10% cần dùng lần lượt là V_1 và V_2.
m_NaOH 3%= 1,05(V_1)3%= 0,0315V_1.
m_NaOH 10% =1,12(V_2)10%= 0,112V_2.
m_NaOH 8%= 1,1.2000.8% =176.
Theo đề bài ta có hệ phương trình:
0,0315V_1 + 0,112V_2= 176 ∩ V_1+ V_2 =2000 => V_1= 96000/161 (mℓ), V_2= 226000/161 (mℓ).

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

gọi V1 là V của HNO3 40 % (ml)
V2 là V của HNO3 10% (ml).ta có :
mdd HNO3 40% = 1.25V1 gam
mdd HNO3 10% = 1.06 V2 gam
mdd HNo3 15%= 2160gam <=> 1.25V1 + 1.06V2 = 2160 (1)
theo qui tắc đường chéo ta có:
m1 : 40 % ........................5
....................15% ......
m2: 10% ........................25
\(\Rightarrow\frac{m1}{m2}=\frac{1}{5}\)
\(\Leftrightarrow\frac{1.25V1}{1.06V2}=\frac{1}{5}\)
\(\Leftrightarrow6.25V1-1.06V2=0\left(2\right)\)
Từ (1 ) và ( 2 ) => \(V1,V2\)


1.
Nồng độ mol/lit của đ NaOH(1)=(3*10*1.05)/40=0.7875
.........................................
......................................... khi trộn là: =(8*10*1.1)/40=2.2
CT tính nông độ mol/lit = (C%*10Ddd)/M
Áp dụng quy tắc đường chéo ta có
Vdd1/(2-Vdd1)=0.42477
---> Vdd1=0.6l
Vdd2=1.4l
1) Gọi thể tích các dung dịch NaOH có nồng độ 3% và 10% cần dùng lần lượt là V_1 và V_2.
m_NaOH 3%= 1,05(V_1)3%= 0,0315V_1.
m_NaOH 10% =1,12(V_2)10%= 0,112V_2.
m_NaOH 8%= 1,1.2000.8% =176.
Theo đề bài ta có hệ phương trình:
0,0315V_1 + 0,112V_2= 176 ∩ V_1+ V_2 =2000 => V_1= 96000/161 (mℓ), V_2= 226000/161 (mℓ).